- WAS WIR TUN

- Branchen

Fallstudie
Neue Lösungen zur KI-Contenterstellung für einen Sport- und Bekleidungsgiganten

- RESSOURCEN
Lionbridge Knowledge Hubs

- WER WIR SIND

„Was wir tun“-Startseite
Generative KI
- KI-Übersetzungsservices
- Content Remix
KI-Training
- Aurora AI Studio™
Maschinelle Übersetzung
- MT Tracker
Smart Onboarding
Übersetzungsservicemodelle
Content-Services
- Technische Redaktion
- Schulungen
- Finanzberichte
- Digitales Marketing
- Content für SEO
Übersetzung und Lokalisierung
- Videolokalisierung
- Software-Lokalisierung
- Websitelokalisierung
- Übersetzung für regulierte Branchen
- Dolmetscherservices
- Live Events
- Sprachliche Qualitätssicherung
Testdienstleistungen<
- Testservice
- Kompatibilitätsprüfungen
- Interoperabilitätsprüfungen
- Performance-Tests
- Zugänglichkeits-Tests
- Überprüfen des Kundenerlebnisses
Branchen-Startseite
Life Sciences Sprachservices
- Pharma-Übersetzungen
- Klinische Prüfung
- Zulassung
- Nach der Zulassung
- Pharma-Kommunikation
- Übersetzungen für Medizinprodukte
- Klinische Prüfung
- Regulierung
- Nach der Zulassung
- Kommunikation für Medizinprodukte
Bank- und Finanzwesen
Einzelhandel
Luxusgüter
E-Commerce
Lionbridge Games
Automobilbranche
Konsumgüter
Technologie
Industrielle Fertigung
Rechtsdienstleistungen
Tourismus & Gastgewerbe
Insights
- Blogbeiträge
- Fallstudien
- Whitepapers
- Lösungsübersichten
- Infografiken
- E-Books
- Videos
Webinare
Lionbridge Knowledge Hubs
- Positive Patientenergebnisse
- Moderne Lösungen für klinische Studien
- Patienteneinbindung
- KI Thought Leadership
SPRACHE AUSWÄHLEN:
2014 wurde die Verordnung über klinische Prüfungen (Clinical Trials Regulation, CTR) veröffentlicht, mit der die für klinische Prüfungen in Europa geltenden Vorschriften grundlegend verändert wurden. Das Jahr 2024 markiert das Ende der dreijährigen Übergangsfrist von der Richtlinie über klinische Prüfungen (Clinical Trials Directive, CTD), die am 31. Januar 2022 zurückgezogen wurde. Zum 31. Januar 2025 tritt die CTR in vollem Umfang in Kraft. Laufende Prüfungen mit einem letzten Patientenbesuch nach dem 30. Januar 2025 müssen von EudraCT auf das Informationssystem für klinische Prüfungen (Clinical Trials Information System, CTIS) umgestellt werden. Nach dieser Umstellung auf die CTR werden die Studien größer ausfallen und der Contentumfang wird zunehmen. Aus diesem Grund werden die richtigen Sprachstrategien für Prüfungssponsoren eine wichtige Rolle spielen. Erfahren Sie mehr über die in der CTR festgelegten sprachlichen Anforderungen und wie KI zu deren Bewältigung beitragen kann.
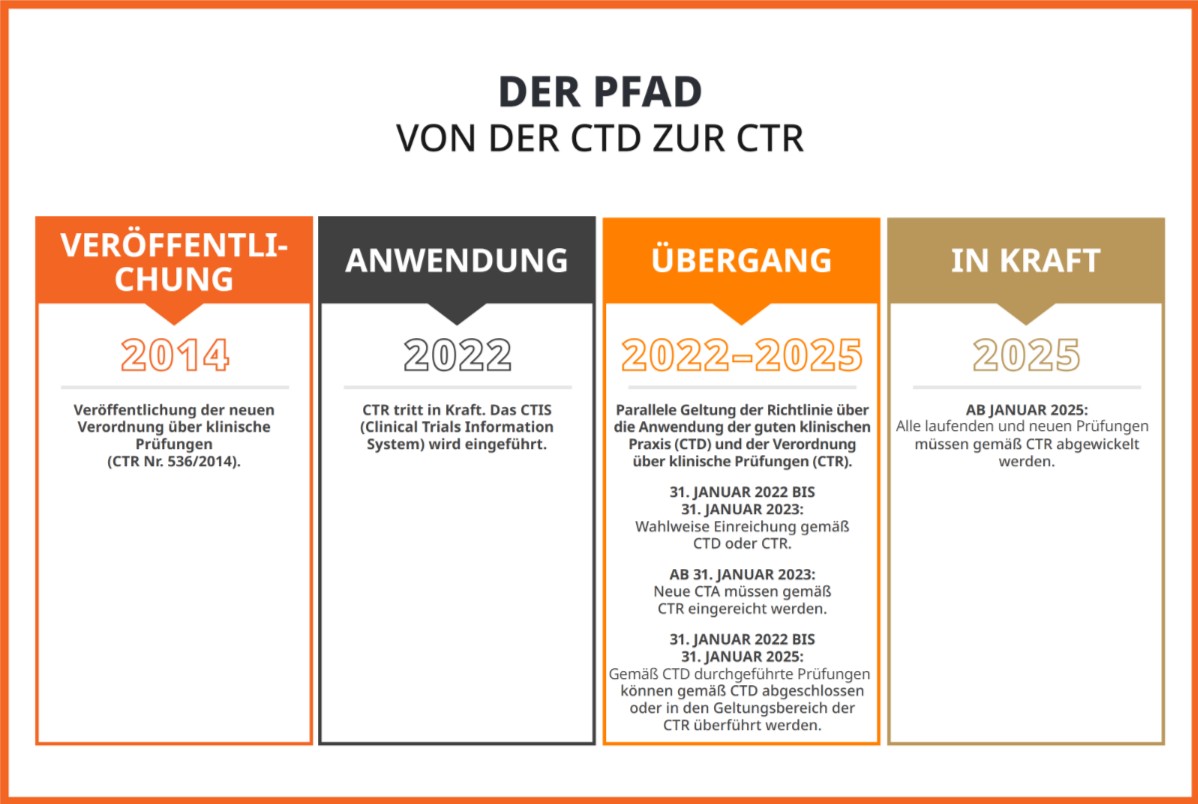
Von der Disruption zur Exzellenz
Ziel der CTR ist die Optimierung der multinationalen klinischen Forschung in der EU. Ungeachtet der durch die Reform zwischenzeitlich verursachten Disruptionen und Belastungen dienen die Änderungen dem Ziel, die Anforderungen zu harmonisieren und die Durchführung klinischer Studien in der Europäischen Union zu optimieren. Mit der Einführung des CTIS wird das Antragsverfahren für klinische Studien in der gesamten EU effizienter gestaltet. Zudem wird es möglich sein, Studien einmalig einzureichen und für alle relevanten Mitgliedstaaten genehmigen zu lassen. Das neue Verfahren bringt eine Verkürzung von 60 auf 45 Tage mit sich. Darin sind Verlängerungsfristen für RFI nicht enthalten.
Außerdem ermöglicht der Übergang von einer Richtlinie zu einer Verordnung in der EU die Harmonisierung der technischen Anforderungen in den Mitgliedstaaten. Das soll die Genehmigung und Durchführung von Studien effizienter gestalten, zum Vorteil von Sponsoren, Patienten und Regulierungsbehörden. Die öffentliche Schnittstelle des CTIS wird zudem mehr Transparenz in der regionalen klinischen Forschung schaffen und Patienten sowie potenziellen Studienteilnehmern den Zugang zu Informationen über regionale klinische Studien ermöglichen.
Zweck der CTR gemäß der Europäischen Arzneimittelagentur:
„(…) Innovation und Forschung in der EU fördern und die Durchführung großer klinischer Studien in mehreren EU-Mitgliedstaaten/EWR-Ländern erleichtern.“
Vorteile der CTIS gemäß der Europäischen Arzneimittelagentur:
- Sponsoren können die Genehmigung klinischer Studien in bis zu 30 europäischen Ländern mit nur einem Onlineformular beantragen
- Nationale Regulierungsbehörden können Anträge auf klinische Studien in mehr als einem Land bearbeiten, weitere Informationen anfordern, Studien genehmigen oder ablehnen und genehmigte Studien überwachen
- Ausweitung von Studien auf andere EWR-Länder wird erleichtert
- Transparenter Zugriff auf die Daten für alle an klinischen Studien im EWR interessierten Personen über eine öffentliche Website mit Suchfunktion
Durchschnittlich sechs Mitgliedstaaten bei multinationalen Studien
Seit Auflegung des CTIS im Jahr 2022 wurden 3657 Anträge auf klinische Studien (Clinical Trial Applications, CTA) eingereicht. Allein im Januar 2024 wurden 309 Anträge eingereicht. Davon waren 170 Erst-CTA. Kommerzielle klinische Studien bildeten den größten Anteil an den multinationalen Studien. Für 1144 multinationale Studien lag bis Januar 2024 eine Entscheidung im CTIS vor, durchschnittlich waren sechs Mitgliedstaaten an diesen Studien beteiligt. Bei all diesen Studien müssen die Einreichungsdokumente mit Content, der in den lokalen Amtssprachen der EU-Mitgliedstaaten verfügbar sein muss, übersetzt werden. Die Verteilung der Erst-CTA für multinationale Studien, die seit Januar 2022 eingereicht wurden, sieht wie folgt aus.

KI-Lösungen: Expansion und Geschwindigkeit dank KI-gestützter Sprachstrategien
Mit der CTR soll die EU für größere klinische Studien attraktiver werden. Die sprachlichen Anforderungen werden jedoch nicht nur das Budget, sondern auch die Mitarbeiter belasten, die klinische Studien beantragen und für die länderspezifischen Prüfungen (ICR) zuständig sind. Zudem muss die Studie sorgfältig geplant werden, damit Folgendes für alle relevanten Sprachen möglich ist:
- Gleichzeitige Einreichung über das CTIS
- Aktualisierungen in den kurzen Zeitfenstern für regulatorische Prüfungen
Das System beruht auf dem Prinzip der impliziten Entscheidung: Der Antrag wird für alle betroffenen Mitgliedstaaten hinfällig, wenn ein Sponsor nicht innerhalb der Frist auf ein Informationsersuchen von Behörden der Mitgliedstaaten antwortet.
Große Sprachmodelle (Large Language Models, LLM) und KI-Services für Life Sciences haben das Potenzial, Übersetzungen für klinische Studien erheblich zu beschleunigen und gleichzeitig die sprachliche Konsistenz auch für umfangreichen Content sicherzustellen. Insbesondere die Qualität der LLM-Ergebnisse verbessert sich rasant. Studiensponsoren können von KI-Lösungen profitieren, indem sie eine solide Sprachstrategie mit LLM und einem vordefinierten Maß an menschlicher Beteiligung kombinieren. Diese Beteiligung reduziert zugleich sämtliche Risiken. Solche Strategien können, wie unten dargestellt, auf mehreren Ebenen entwickelt werden.

Nehmen Sie Kontakt mit uns auf
Benötigen Sie Unterstützung bei der Entwicklung einer Strategie für Life-Sciences-Übersetzungen? Interessieren Sie sich für KI-Lösungen für Life Sciences? Lionbridge verfügt über jahrzehntelange Erfahrung und Expertise bei der Übersetzung von klinischen Studien. Setzen Sie sich mit uns in Verbindung, wenn Sie mehr über Lionbridge als Sprachdienstleister im Bereich Life Sciences erfahren möchten.



