KI-Lösungen


Fallstudie
Neue Lösungen zur KI-Contenterstellung für einen Sport- und Bekleidungsgiganten

- RESSOURCEN
Lionbridge Knowledge Hubs
- LLM-Einschränkungen überwinden
- Positive Patientenergebnisse


In einem früheren Blogbeitrag haben wir den mehrsprachigen EU-Markt behandelt und erörtert, wie sich die Politik der Mehrsprachigkeit der Europäischen Union auf die Compliance mit den sprachlichen Anforderungen für Life-Sciences-Übersetzungen auswirkt. In diesem Blogbeitrag befassen wir uns mit den drei Bereichen sprachlicher Anforderungen, die insbesondere für folgende Gruppen relevant sind:
- Medizinprodukthersteller
- Stakeholder
- Studiensponsor für Medizinprodukte, die für die EU bestimmt sind
Ermittlung des regulatorischen Übersetzungsbedarfs in der EU
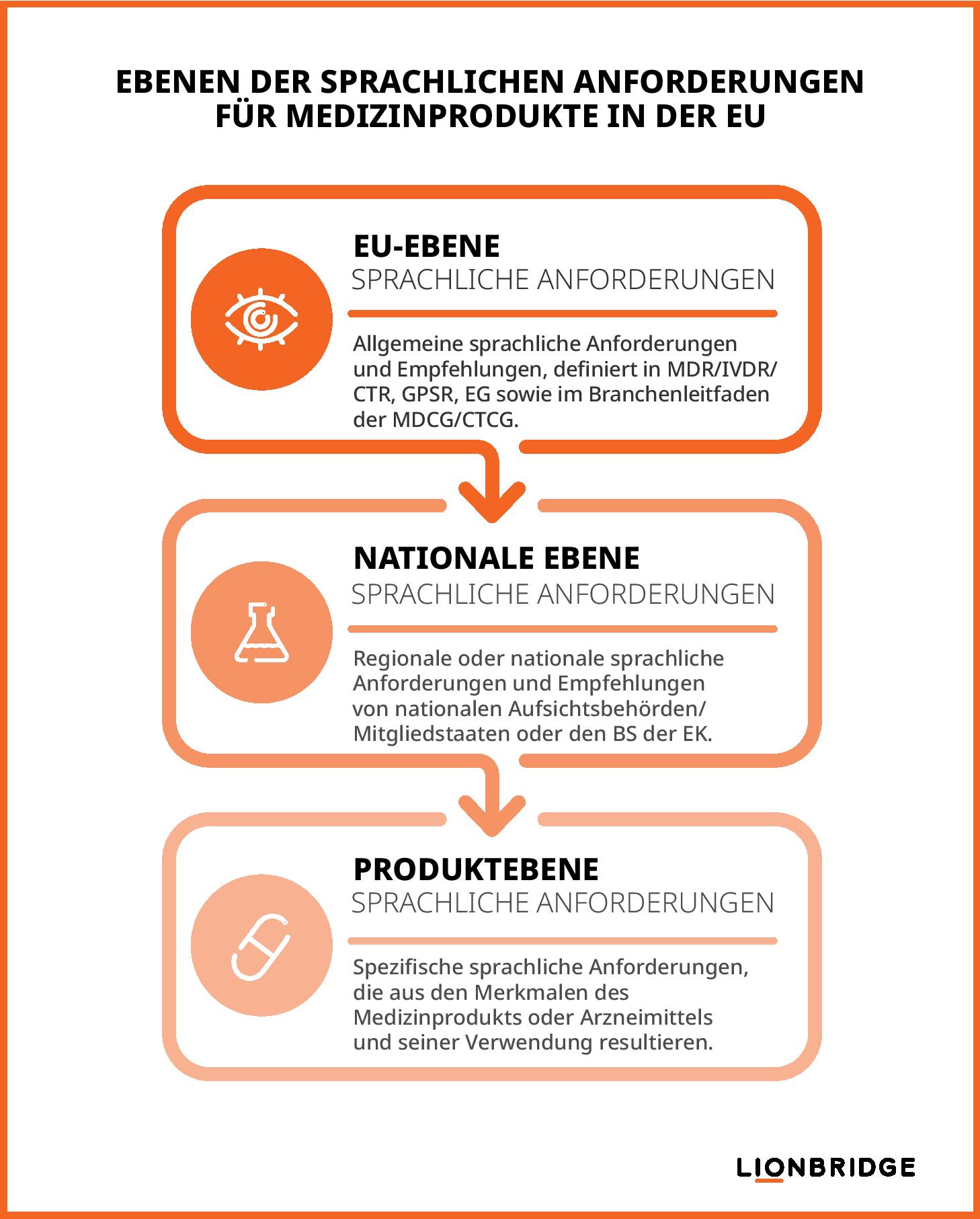
Gemäß den EU-Verordnungen für Medizinprodukte und klinische Prüfungen müssen Hersteller sowie Sponsoren klinischer Prüfungen die folgenden drei Bereiche sprachlicher Anforderungen berücksichtigen, um die Compliance mit den Life-Sciences-Vorschriften sicherzustellen:
EU-Anforderungen: definiert in der MDR/IVDR/CTR, der allgemeinen Produktsicherheitsverordnung (GPSR), den Veröffentlichungen der Europäischen Kommission (EK) und den von der Koordinierungsgruppe für Medizinprodukte (MDCG) oder klinische Prüfungen (CTCG) veröffentlichten Branchenleitlinien.
Nationale Anforderungen: festgelegt von den zuständigen nationalen Behörden der einzelnen Mitgliedstaaten und teilweise von benannten Stellen im Rahmen der Konformitätsbewertungsverfahren für Medizinprodukte oder von Ethikkommissionen im Rahmen der Genehmigungsverfahren für klinische Studien durchgesetzt.
Produktspezifische Anforderungen: resultierend aus produktspezifischen Erwägungen wie Nutzungskontext, Produktmerkmalen, vorgesehenen Benutzern und Einsatzzwecken.
Sprachliche Anforderungen der EU für Compliance mit den Life-Sciences-Vorschriften
Die sprachlichen Anforderungen der EU sind allgemeiner Natur. Grundsätzlich unterliegen alle in der EU in Verkehr gebrachten Verbraucherprodukte der Produktsicherheitsverordnung (GPSR). Die GPSR schreibt vor, dass die folgenden Dokumente in den von den Mitgliedstaaten, in denen die Produkte in Verkehr gebracht werden, festgelegten Amtssprachen verfügbar gemacht werden:
- Bedienungsanleitungen
- Kennzeichnungen
- Dokumentation (für Verbraucherprodukte)
Bei Produkten wie Medizinprodukten und Arzneimitteln, für die zusätzliche Sicherheits- und Leistungsanforderungen definiert sind, gelten die Sprachanforderungen nicht nur für die Kennzeichnung und die mit dem Produkt bereitgestellten Informationen. Sie werden beispielsweise dann relevant, wenn der Hersteller mittels prägnanter, laienverständlicher oder lokaler Sprache Sicherheit und Funktion der Produkte unterstützen muss. Die sprachlichen Anforderungen der EU legen nicht fest, welche Sprachen für welche Mitgliedstaaten erforderlich sind.
Nationale sprachliche Anforderungen
Die NCA (National Competent Authorities) legen fest, in welchen Landessprachen welche Dokumente zu Medizinprodukten oder Arzneimitteln bereitgestellt werden müssen. Um die Patientensicherheit zu gewährleisten, muss der sich an Patienten richtende Content in den Sprachen der betreffenden Mitgliedstaaten bereitgestellt werden. Die Behörden der Mitgliedstaaten berücksichtigen aber auch andere Aspekte der Kommunikation, beispielsweise:
- Lese- und Schreibfähigkeit der Verbraucher
- Technisches und medizinisches Wissen
- Schulungen
Die NCA der EU entscheiden – durchaus unterschiedlich –, ob Englisch allgemein verstanden wird und ob Content für professionelle Benutzer in englischer Sprache zulässig ist. In einigen Mitgliedstaaten wie Frankreich, Italien und verschiedenen osteuropäischen Mitgliedstaaten wie Bulgarien, Ungarn und Litauen muss folgender Content in Landessprache veröffentlicht werden:
- Marketing
- Sicherheitsanweisungen im Feld
- Zertifizierung
In einigen Ländern ist Englisch ausnahmsweise zulässig, beispielsweise in den nordeuropäischen Mitgliedsstaaten Dänemark und Schweden.
Produktspezifische sprachliche Anforderungen
Zu den produktspezifischen Anforderungen zählen spezielle Einsatzszenarien für bestimmte Medizinprodukte oder Arzneimittel, z. B. ein Gerät zur In-vitro-Diagnostik für Selbsttests oder Tests in Patientennähe oder eine Mobilgerätanwendung zur Erfassung von Patientendaten.
Hersteller müssen den spezifischen Kontext der Nutzung von Medizinprodukten oder Arzneimitteln beachten, um die sprachlichen Anforderungen für Situationen zu bestimmen, in denen sich diese Anforderungen nicht aus EU- oder nationalen Veröffentlichungen ergeben. Unsere Experten für Lösungen für globale regulatorische Angelegenheiten empfehlen, im Zweifelsfall die zuständige benannte Stelle oder die zuständigen NCA zu konsultieren, bevor ein Medizinprodukt oder Arzneimittel in Verkehr gebracht oder klinischen Prüfungen unterzogen wird.
Sprache fördert Zugang, Sicherheit und Transparenz
Hersteller sowie Sponsoren klinischer Studien müssen vor dem Inverkehrbringen in der EU sicherstellen, dass die sprachlichen Anforderungen für Life Sciences eingehalten werden. Sprachliche Aspekte können aber nicht einfach abgehakt werden. Informationen müssen in den lokalen EU-Sprachen verfügbar gemacht werden, damit sie für alle Produktbenutzer und Testpersonen zugänglich, lesbar und transparent sind. Darüber hinaus können Hersteller ihre Marktpräsenz mit hochwertigen Übersetzungen und durch die Berücksichtigung kultureller Nuancen ausbauen und für die sichere Nutzung ihrer Produkte sorgen.
Kontaktieren Sie uns
Stellen die sprachlichen Vorschriften der mehrsprachigen EU eine Herausforderung für Sie dar? Entwickeln Sie gemeinsam mit Lionbridge Lösungen für die regulatorischen Anforderungen der EU. Wir verfügen über jahrzehntelange Erfahrung mit den EU-Sprachen sowie den Verordnungen der EU zu Medizinprodukten und Arzneimitteln. Mit unseren Übersetzungs- und Sprachservices für Life Sciences unterstützen wir Sie in jeder Produktphase.