- SERVIZI OFFERTI
Servizi Aggiuntivi

Webinar
Elaborazione di un'analisi strategica dei ricavi per l'ingresso in un mercato locale

- Settori

- RISORSE
Hub di conoscenze Lionbridge
Risultati positivi per i pazienti

Framework TRUST di Lionbridge
Rafforzare la fiducia nell'uso dell'intelligenza artificiale

- CHI SIAMO

Collaboratori internazionali: Lex Parisi
Director of Gaming Marketing Solutions di Lionbridge Games

Home Servizi offerti
Intelligenza artificiale generativa
- Servizi di Traduzione IA
- Content Remix
Addestramento dell'intelligenza artificiale
- Aurora AI Studio™
Traduzione automatica
- MT Tracker
Smart Onboarding
Modelli di servizi di traduzione
Servizi per i contenuti
- Redazione di testi tecnici
- Formazione e eLearning
- Report finanziari
- Marketing digitale
- SEO e ottimizzazione dei contenuti
Servizi di traduzione
- Localizzazione di video
- Localizzazione di software
- Localizzazione di siti web
- Traduzione di contenuti regolamentati
- Interpretariato
- Eventi live
- Language Quality Services
Servizi di test
- Test funzionali per il controllo della qualità
- Test di compatibilità
- Test di interoperabilità
- Test delle prestazioni
- Test di accessibilità
- UX/CX Testing
Home Settori
Traduzioni Life Science
- Traduzioni farmaceutiche
- Traduzioni di trial clinici
- Traduzioni normative
- Traduzioni post-approvazione
- Traduzioni farmaceutiche aziendali
- Servizi linguistici per dispositivi medici
- Convalida e contenuti clinici
- Traduzioni normative
- Traduzioni post-autorizzazione
- Traduzioni per dispositivi medici aziendali
Bancario e finanziario
Retail
Lusso
E-Commerce
Lionbridge Games
Automotive
Beni di largo consumo
Tecnologico
Produzione industriale
Servizi in ambito legale
Viaggi e turismo
Approfondimenti
- Post di blog
- Case study
- White paper
- Solution brief
- Infografiche
- eBook
- Video
Webinar
Hub di conoscenze Lionbridge
- Risultati positivi per i pazienti
- Soluzioni per i moderni trial clinici
- Interazione con i pazienti
- Leadership di pensiero nell'AI
SELEZIONATE LA LINGUA:
Nel 2014 è stato pubblicato il Regolamento sui trial clinici (CTR, Clinical Trials Regulation), che ha cambiato radicalmente il panorama normativo dei trial clinici in Europa. Il 2024 segna anche la fine del periodo di transizione di tre anni dalla Direttiva sui trial clinici (CTD, Clinical Trials Directive), abrogata il 31 gennaio 2022. Il 31 gennaio 2025 il CTR acquisirà piena efficacia. I trial in corso con ultima visita dei pazienti successiva al 30 gennaio 2025 dovranno passare da EudraCT al sistema informativo sulle sperimentazioni cliniche (CTIS, Clinical Trials Information System). Una volta che la transizione sarà compiuta, gli sponsor dei trial si renderanno conto dell'importanza di una strategia linguistica per i trial clinici, poiché questi ultimi diventeranno più estesi e il volume dei contenuti aumenterà con l'applicazione del CTR. Continuate a leggere per comprendere le potenziali sfide linguistiche del CTR e come l'intelligenza artificiale possa essere di aiuto.
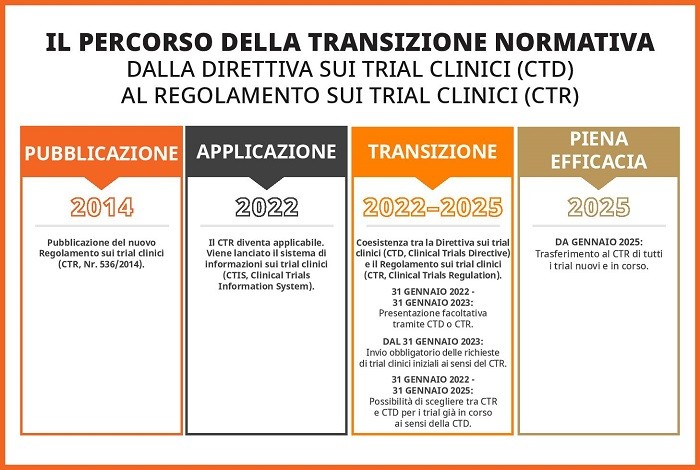
Dal cambiamento all'eccellenza
Il CTR è stato implementato per promuovere la ricerca clinica multinazionale nell'Unione europea. Nonostante il periodo di transizione della riforma comporti oneri e disagi, i cambiamenti sono funzionali all'ambizioso obiettivo di armonizzare i requisiti e di ottimizzare l'esecuzione dei trial clinici nell'intera Unione. Con l'implementazione del sistema informativo sulle sperimentazioni cliniche (CTIS), la procedura di presentazione delle domande di autorizzazione per i trial clinici diventerà più efficiente in tutti gli Stati membri. Sarà anche possibile presentare un'unica richiesta e una valutazione congiunta in tutti gli Stati membri interessati. La nuova procedura riduce i 60 giorni standard a 45, senza contare i periodi di estensione per la richiesta di informazioni.
Inoltre, la transizione legale da una Direttiva a un Regolamento nell'UE consente l'armonizzazione dei requisiti tecnici tra gli Stati membri. Questo effetto dovrebbe rendere più efficienti le approvazioni e l'esecuzione dei trial, offrendo così un vantaggio a sponsor, pazienti e autorità di regolamentazione. L'interfaccia pubblica del CTIS garantirà anche maggiore trasparenza della ricerca clinica regionale e offrirà ai pazienti e ai potenziali partecipanti ai trial l'accesso alle informazioni sui trial clinici regionali.
Scopo del CTR come descritto dall'Agenzia europea per i medicinali:
"…promuovere l'innovazione e la ricerca nell'UE semplificando lo svolgimento di trial clinici più ampi in diversi Stati membri dell'UE/paesi del SEE."
Vantaggi del CTIS come descritto dall'Agenzia europea per i medicinali:
- Consente agli sponsor di richiedere l'autorizzazione a un trial clinico in un massimo di 30 paesi europei con un'unica domanda online.
- Consente alle autorità di regolamentazione nazionali di trattare in modo collaborativo le domande di autorizzazione per trial clinici presentate in più di un paese, di richiedere ulteriori informazioni, di autorizzare o rifiutare un trial e di supervisionare un trial autorizzato.
- Facilita l'espansione dei trial in altri paesi del SEE.
- Garantisce trasparenza e accesso alle informazioni per qualsiasi parte interessata ai trial clinici condotti nello Spazio Economico Europeo, attraverso un sito web pubblico di libera consultazione.
Una media di sei Stati membri per i trial multinazionali
Dal momento del lancio del CTIS, nel 2022, sono state presentate 3.657 domande di autorizzazione per trial clinici. Solo nel gennaio 2024 sono state presentate 309 domande di autorizzazione per trial clinici. Di queste, 170 erano domande di autorizzazione iniziale, con i trial clinici commerciali che rappresentano la percentuale più alta tra i trial multinazionali. Entro gennaio 2024, il CTIS ha gestito le decisioni per 1.144 trial clinici multinazionali, con in media sei Stati membri per ogni trial. Tutti questi trial necessitano della traduzione dei dossier di presentazione per i contenuti richiesti nelle lingue ufficiali locali dei Paesi membri dell'UE. Di seguito è rappresentata la distribuzione delle domande di autorizzazione iniziale per trial multinazionali presentate da gennaio 2022.

Soluzioni basate sull'intelligenza artificiale: espansione e velocità richiedono strategie linguistiche basate sull'intelligenza artificiale
Man mano che il CTR promuoverà l'esecuzione di trial clinici più estesi nell'Unione europea, l'aspetto linguistico avrà un peso sempre maggiore sui budget dei trial e sul personale che si occupa della gestione delle domande di autorizzazione e delle revisioni locali per i trial clinici. Sarà inoltre necessaria un'attenta pianificazione linguistica durante la preparazione dei trial per assicurarsi che tutte le lingue siano pronte per:
- la presentazione simultanea tramite il CTIS
- eventuali aggiornamenti durante le brevi finestre di revisione normativa
Il sistema si basa su un principio decisionale tacito. Ciò significa che se uno sponsor non risponde entro la scadenza di una richiesta di informazioni da parte delle autorità dello Stato membro, la domanda scadrà per tutti gli Stati membri interessati.
I Large Language Model (LLM) e i servizi di intelligenza artificiale per il settore Life Science possono aiutare ad accelerare significativamente le traduzioni per i trial clinici assicurando al contempo la coerenza linguistica tra grossi volumi di contenuti. È importante sottolineare che la qualità dei risultati degli LLM sta migliorando rapidamente. Gli sponsor dei trial possono sfruttare le soluzioni di intelligenza artificiale combinando una solida strategia linguistica con gli LLM, con livelli predefiniti di intervento umano. In questo modo, sarà anche possibile ridurre i rischi. Tali strategie possono essere progettate a più livelli, come suggerito di seguito.

Contattateci
Vi serve assistenza per lo sviluppo di una strategia per le traduzioni per il settore Life Science? Volete saperne di più sulle soluzioni di intelligenza artificiale per il settore Life Science? Lionbridge vanta decenni di profonda conoscenza ed esperienza nelle traduzioni di trial clinici. Contattateci oggi stesso per scoprire di più sul ruolo di Lionbridge come fornitore di servizi linguistici per il settore Life Science.

