- SERVIZI OFFERTI
Servizi Aggiuntivi

Webinar
Elaborazione di un'analisi strategica dei ricavi per l'ingresso in un mercato locale

- Settori

- RISORSE
Hub di conoscenze Lionbridge
Risultati positivi per i pazienti

Framework TRUST di Lionbridge
Rafforzare la fiducia nell'uso dell'intelligenza artificiale

- CHI SIAMO

Collaboratori internazionali: Lex Parisi
Director of Gaming Marketing Solutions di Lionbridge Games

Home Servizi offerti
Intelligenza artificiale generativa
- Servizi di Traduzione IA
- Content Remix
Addestramento dell'intelligenza artificiale
- Aurora AI Studio™
Traduzione automatica
- MT Tracker
Smart Onboarding
Modelli di servizi di traduzione
Servizi per i contenuti
- Redazione di testi tecnici
- Formazione e eLearning
- Report finanziari
- Marketing digitale
- SEO e ottimizzazione dei contenuti
Servizi di traduzione
- Localizzazione di video
- Localizzazione di software
- Localizzazione di siti web
- Traduzione di contenuti regolamentati
- Interpretariato
- Eventi live
- Language Quality Services
Servizi di test
- Test funzionali per il controllo della qualità
- Test di compatibilità
- Test di interoperabilità
- Test delle prestazioni
- Test di accessibilità
- UX/CX Testing
Home Settori
Traduzioni Life Science
- Traduzioni farmaceutiche
- Traduzioni di trial clinici
- Traduzioni normative
- Traduzioni post-approvazione
- Traduzioni farmaceutiche aziendali
- Servizi linguistici per dispositivi medici
- Convalida e contenuti clinici
- Traduzioni normative
- Traduzioni post-autorizzazione
- Traduzioni per dispositivi medici aziendali
Bancario e finanziario
Retail
Lusso
E-Commerce
Lionbridge Games
Automotive
Beni di largo consumo
Tecnologico
Produzione industriale
Servizi in ambito legale
Viaggi e turismo
Approfondimenti
- Post di blog
- Case study
- White paper
- Solution brief
- Infografiche
- eBook
- Video
Webinar
Hub di conoscenze Lionbridge
- Risultati positivi per i pazienti
- Soluzioni per i moderni trial clinici
- Interazione con i pazienti
- Leadership di pensiero nell'AI
SELEZIONATE LA LINGUA:
Nella nostra nuova serie dedicata al COVID-19, gli esperti di Lionbridge discutono dell'ecosistema dello sviluppo clinico e delle approvazioni normative durante la pandemia e in futuro.
Grazie alla presenza internazionale, all'eccellenza dei servizi e all'ampia gamma di soluzioni linguistiche, di comunicazione e tecnologiche, Lionbridge è in una posizione privilegiata per supportare qualsiasi attività finalizzata a portare sul mercato vaccini e terapie salvavita in tempi rapidi.
Le statistiche presenti in questo articolo sono aggiornate a lunedì 7 dicembre 2020.
La corsa al vaccino anti COVID-19
La ricerca del vaccino anti COVID-19 procede ad alta velocità. Lo sviluppo di candidati vaccini sta avvenendo con un ritmo senza precedenti, che fa sembrare una passeggiata il percorso standard per lo sviluppo di nuovi trattamenti. Si tratta di una corsa contro un costo sempre maggiore di vite umane, che richiede la partecipazione di tutte le parti coinvolte nell'infrastruttura sanitaria internazionale. Fino a questo momento, la pandemia ha provocato oltre 1,5 milioni di morti e 66 milioni di casi confermati e i numeri sono in aumento in tutto il mondo, secondo l'OMS.
A questo punto della corsa, ci sono 1.157 trial nella pipeline clinica internazionale che studiano l'infezione da SARS-CoV e almeno 100 vaccini in via di sviluppo. Il 20 novembre, Pfizer e BioNTech hanno annunciato che avrebbero presentato all'FDA un'autorizzazione all'uso di emergenza per il loro candidato vaccino BNT162b2. Il 25 novembre, Moderna ha annunciato che la Commissione europea ha approvato un contratto di acquisto anticipato per 80 milioni di dosi del loro candidato vaccino mRNA-1273.
Altri candidati nelle ultime fasi della pipeline includono il vaccino di AstraZeneca, noto come AZD1222, sviluppato in collaborazione con l'Università di Oxford, e il vaccino ricombinante Ad5-nCoV, sviluppato dalla società cinese CanSino Biologics.

Maggiore velocità con la stessa qualità
Il senso di urgenza e i cambiamenti radicali sono in genere i meccanismi di risposta più potenti per combattere una minaccia emergente e senza dubbio questa pandemia lo sta dimostrando. L'eccellenza operativa e lo svolgimento di trial virtuali sono stati fondamentali nello sviluppo di nuovi vaccini contro il COVID-19 e l'urgenza e la gravità della pandemia non consentono compromessi sulla qualità.
Le autorità di regolamentazione di tutto il mondo offrono percorsi accelerati per la consulenza scientifica e l'autorizzazione all'uso di emergenza. Nello stesso tempo, sottolineano l'importanza sia della quantità che della qualità dei dati sperimentali per ottenere l'approvazione.
La pubblicazione di ottobre dell'FDA, Emergency Use Authorization for Vaccines to Prevent COVID-19, affronta la questione della qualità. L'autorizzazione all'uso di emergenza viene rilasciata solo se l'ente determina che "i benefici del vaccino superano i rischi sulla base dei dati di almeno un trial di fase 3 ben documentato che dimostri l'efficacia e la sicurezza del vaccino in modo chiaro e convincente".
Equilibrio costante tra sicurezza, efficacia e qualità
Nell'attuale pipeline clinica per i vaccini anti COVID-19 sono in corso trial di fase 3 estensivi, con fino a 40.000 partecipanti in centinaia di sedi e condotti con una velocità impressionante. Il trial per l'efficacia e la sicurezza di fase 2/3 di Pfizer per il relativo candidato vaccino (BNT162b2) è stato avviato solo tre mesi dopo l'inizio dei trial per la sicurezza e l'immunogenicità di fase 1/2. E dopo solo due ore dal via libera dell'FDA, Pfizer ha somministrato la prima dose di vaccino al primo partecipante al trial.
In Russia, al 23 novembre erano stati approvati due vaccini. Tuttavia, entrambi questi vaccini sono stati approvati dal Ministero della Salute russo prima del passaggio alla fase 3. L'annuncio di agosto di Vladimir Putin è stato accolto con grande preoccupazione dagli esperti di vaccini che hanno definito questa accelerazione normativa "estremamente stupida", oltre che "davvero spaventosa e rischiosa".
Lo sviluppo dei farmaci richiede un equilibrio costante tra sicurezza, efficacia e qualità e nella corsa alla ricerca di un vaccino la velocità deve andare di pari passo con l'affidabilità e l'integrità dei dati.
Dalla competizione alla collaborazione: una corsa contro il tempo
Durante la pandemia, operatori del settore che in genere sono in competizione per riuscire a immettere per primi sul mercato nuove terapie innovative hanno mostrato un eccezionale impegno nella collaborazione. Tecnologie proprietarie e competenze (che normalmente le aziende farmaceutiche custodiscono molto gelosamente) vengono ora condivise per accelerare lo sviluppo di un vaccino anti COVID-19.
Una di queste partnership è la collaborazione tra GSK e Sanofi, due dei maggiori produttori di vaccini al mondo e rivali da lungo tempo. GSK ha concesso a Sanofi l'accesso alla sua tecnologia coadiuvante che, in combinazione con il candidato vaccino di Sanofi, può migliorare la risposta immunitaria e ridurre la quantità necessaria di vaccino per dose. Questo miglioramento sarà fondamentale, considerata l'entità della pandemia e l'impegno dei partner nei confronti del governo degli Stati Uniti a fornire fino a 100 milioni di dosi.
Un gioco di squadra: implementazione simultanea delle fasi
Una velocità di sviluppo come questa è un record.
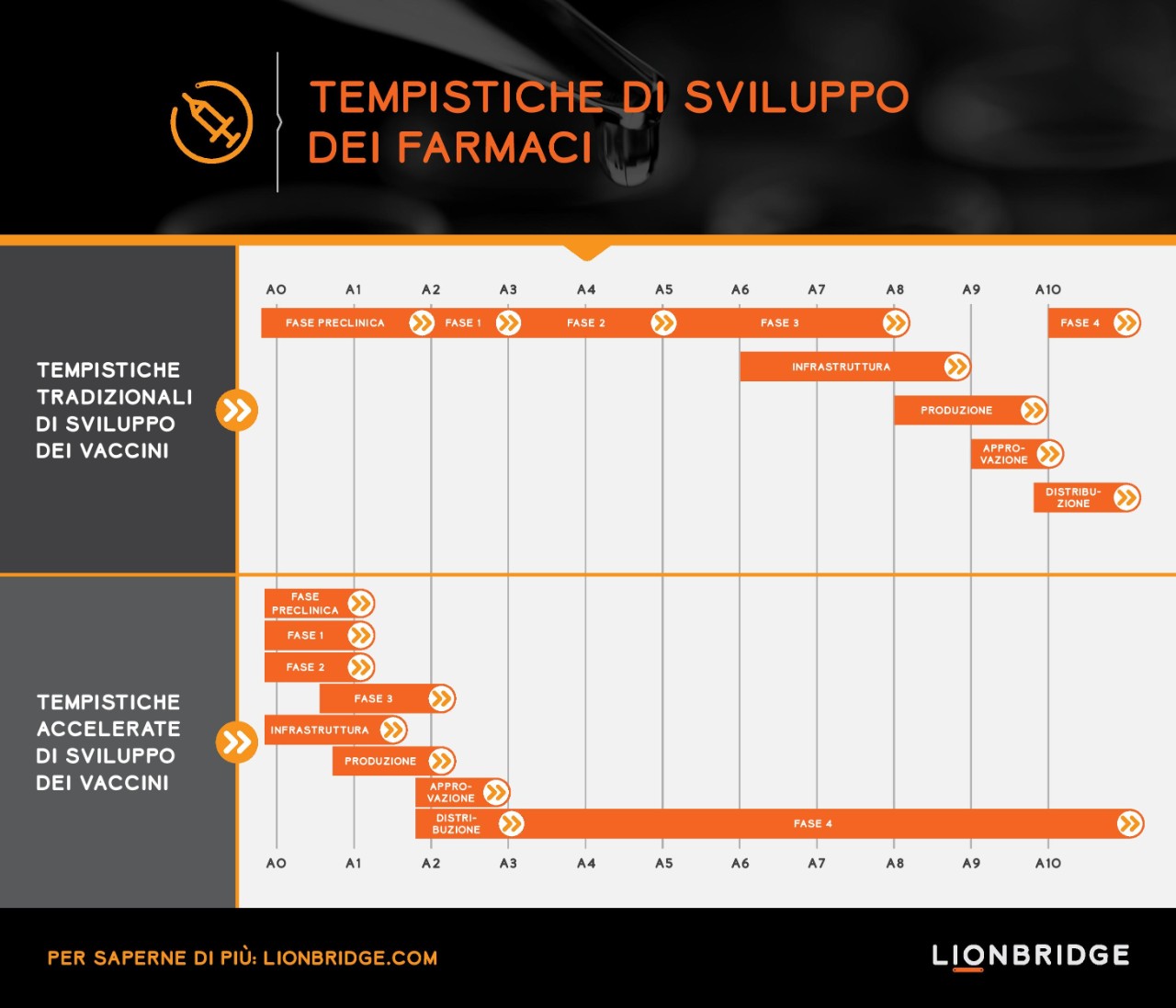
Lo sviluppo di un vaccino richiede solitamente più di dieci anni, dalla scoperta alla concessione della licenza normativa fino al programma di sviluppo clinico che avviene in fasi sequenziali. Il percorso accelerato che vediamo attualmente per lo sviluppo dei vaccini anti COVID-19 segue una modalità di esecuzione parallela. Vengono implementati trial senza soluzione di continuità che combinano la fase 1/2 e la fase 2/3 per accelerare il percorso di sviluppo. I trial includono diverse misure di esito, partecipanti provenienti da Paesi differenti e più candidati vaccini.
Pfizer, ad esempio, ha testato quattro candidati in parallelo nel trial di fase 1/2 prima di scegliere il candidato principale per la fase 2/3 (BNT162b2). Per il trial di fase 2/3 del vaccino BNT162b2 sono stati coinvolti circa 44.000 partecipanti in 155 sedi in Stati Uniti, Argentina, Brasile, Germania, Sudafrica e Turchia. La portata di questo trial non è solo ampia per quanto riguarda il numero di partecipanti e le sedi, ma anche per la diversità tra la popolazione coinvolta. Lo studio è stato avviato con partecipanti adulti di tre diversi gruppi di età fino agli 85 anni e successivamente ampliato per includere gli adolescenti a partire dai 12 anni. Il vaccino è stato inoltre testato su persone affette da HIV cronico ed epatite B o C. Pfizer e BioNTech, che hanno collaborato allo sviluppo del vaccino, prevedono di produrre fino a 50 milioni di dosi nel 2020 e 1,3 miliardi di dosi entro la fine del 2021.
Impatto del COVID-19 sul modello di servizio futuro.
La pandemia di COVID-19 ha dimostrato come un percorso di sviluppo standard di otto anni dalla fase preclinica al termine della fase 3 possa essere ridotto a soli due anni, con la possibilità per un vaccino di essere immesso sul mercato in soli tre anni. Una velocità di sviluppo come questa è un record. È per questo che prevediamo che i vaccini saranno disponibili entro la fine di quest'anno.

Questo impegno internazionale senza precedenti di operatori del settore, organismi normativi, governi e organizzazioni sanitarie servirà ad accelerare lo sviluppo di altre terapie salvavita o per malattie rare per cui non sono disponibili cure per i pazienti? Perché questi pazienti non dovrebbero beneficiare dell'eccellenza operativa che abbiamo visto durante la pandemia? La pandemia non solo ha dimostrato che è possibile accelerare di diversi anni lo sviluppo e la produzione, ma ha anche potenziato l'uso di infrastrutture digitali e strumenti come diari elettronici, telemedicina, smartphone e dispositivi indossabili che hanno contribuito ad accelerare l'esecuzione dei trial.
L'esecuzione accelerata avrà un impatto sull'intera catena di fornitura e sui fornitori di servizi che dovranno operare con maggiore velocità e agilità per soddisfare i requisiti del settore e delle autorità di regolamentazione. Per un fornitore di servizi linguistici, l'accelerazione degli studi clinici e delle autorizzazioni all'immissione in commercio avrà un impatto sul modello di servizio e richiederà prestazioni eccellenti in termini di esecuzione, risorse e capacità linguistiche. L'uso di risorse linguistiche, automazione e scalabilità diventerà fondamentale per fornire una suite di servizi rapidi assicurando una qualità del linguaggio eccellente per gestire i rischi.