- SERVIZI OFFERTI
Servizi Aggiuntivi

Webinar
Elaborazione di un'analisi strategica dei ricavi per l'ingresso in un mercato locale

- Settori

- RISORSE
Hub di conoscenze Lionbridge
Risultati positivi per i pazienti

Framework TRUST di Lionbridge
Rafforzare la fiducia nell'uso dell'intelligenza artificiale

- CHI SIAMO

Collaboratori internazionali: Lex Parisi
Director of Gaming Marketing Solutions di Lionbridge Games

Home Servizi offerti
Intelligenza artificiale generativa
- Servizi di Traduzione IA
- Content Remix
Addestramento dell'intelligenza artificiale
- Aurora AI Studio™
Traduzione automatica
- MT Tracker
Smart Onboarding
Modelli di servizi di traduzione
Servizi per i contenuti
- Redazione di testi tecnici
- Formazione e eLearning
- Report finanziari
- Marketing digitale
- SEO e ottimizzazione dei contenuti
Servizi di traduzione
- Localizzazione di video
- Localizzazione di software
- Localizzazione di siti web
- Traduzione di contenuti regolamentati
- Interpretariato
- Eventi live
- Language Quality Services
Servizi di test
- Test funzionali per il controllo della qualità
- Test di compatibilità
- Test di interoperabilità
- Test delle prestazioni
- Test di accessibilità
- UX/CX Testing
Home Settori
Traduzioni Life Science
- Traduzioni farmaceutiche
- Traduzioni di trial clinici
- Traduzioni normative
- Traduzioni post-approvazione
- Traduzioni farmaceutiche aziendali
- Servizi linguistici per dispositivi medici
- Convalida e contenuti clinici
- Traduzioni normative
- Traduzioni post-autorizzazione
- Traduzioni per dispositivi medici aziendali
Bancario e finanziario
Retail
Lusso
E-Commerce
Lionbridge Games
Automotive
Beni di largo consumo
Tecnologico
Produzione industriale
Servizi in ambito legale
Viaggi e turismo
Approfondimenti
- Post di blog
- Case study
- White paper
- Solution brief
- Infografiche
- eBook
- Video
Webinar
Hub di conoscenze Lionbridge
- Risultati positivi per i pazienti
- Soluzioni per i moderni trial clinici
- Interazione con i pazienti
- Leadership di pensiero nell'AI
SELEZIONATE LA LINGUA:
In un blog precedente abbiamo parlato del mercato multilingue dell'Unione europea e di come la relativa politica multilingue influisca sulla conformità normativa nel settore per quanto riguarda i requisiti linguistici delle traduzioni di documenti da sottoporre alle autorità di regolamentazione. Questo blog approfondirà i tre livelli di requisiti linguistici che questi gruppi devono conoscere:
- Produttore del dispositivo
- Operatore economico
- Sponsor dei trial per i prodotti medici dell'UE
Determinazione dei requisiti per le traduzioni di documenti da sottoporre alle autorità di regolamentazione nell'UE
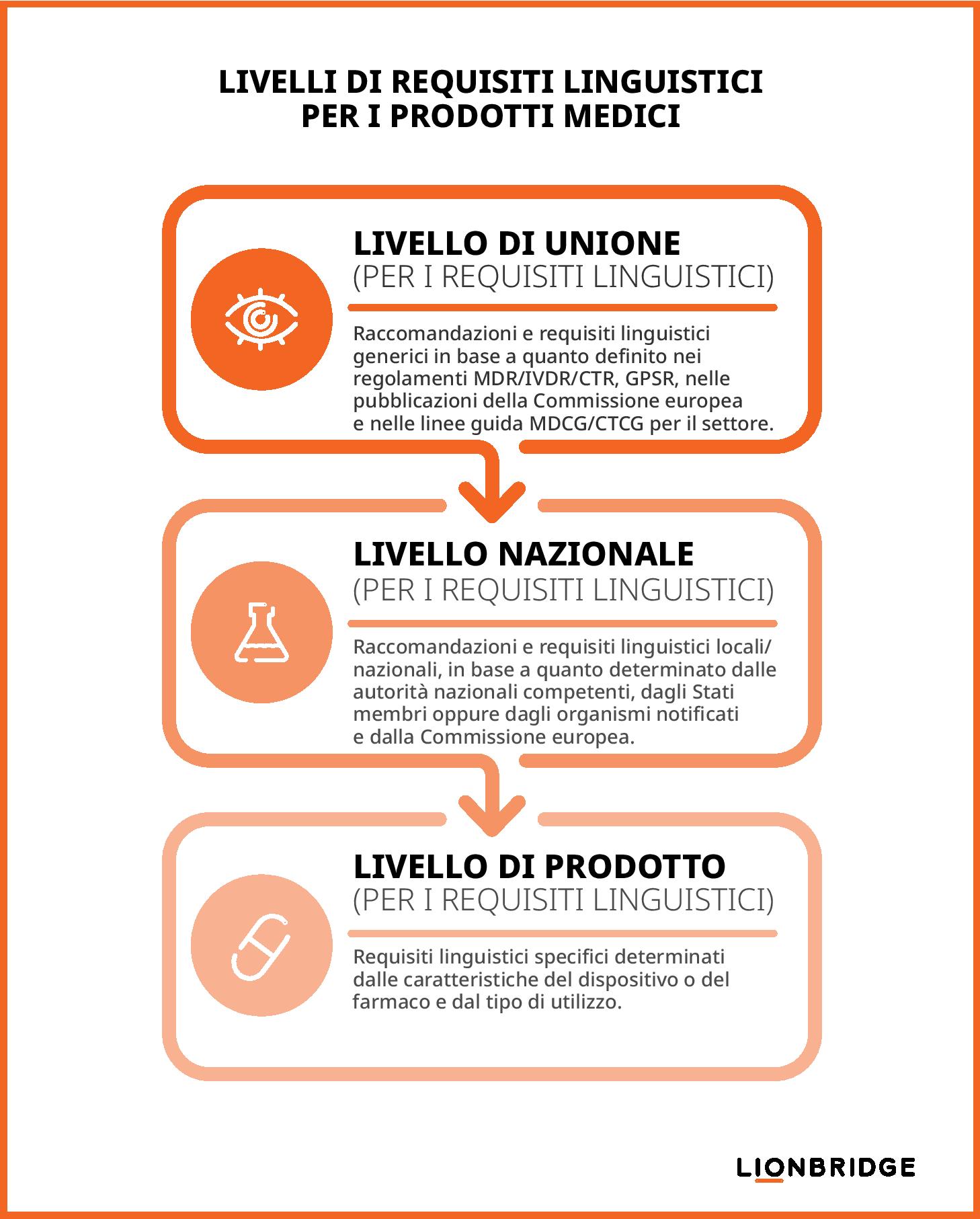
Ai sensi dei Regolamenti UE sui dispositivi medici e sulla sperimentazione clinica, un produttore o uno sponsor di sperimentazione clinica deve considerare questi tre livelli di requisiti linguistici per garantire la conformità alle normative del settore Life Science.
Requisiti a livello di Unione: definiti nei regolamenti MDR/IVDR/CTR e GPSR (General Product Safety Regulation), nelle pubblicazioni della Commissione europea (EC) e nelle linee guida di settore pubblicate dal Medical Device Coordination Group (MDCG) o dal Clinical Trials Coordination Group (CTCG)
Requisiti a livello nazionale: determinati dalle autorità nazionali competenti di ciascuno Stato membro e in parte applicati dagli organismi notificati nell'ambito delle procedure di valutazione della conformità dei dispositivi medici o dai comitati etici nell'ambito delle procedure di autorizzazione dei trial clinici.
Requisiti a livello di prodotto: determinati da considerazioni specifiche sul prodotto, come il contesto d'uso, le caratteristiche del prodotto oppure gli utenti o gli scopi previsti.
Requisiti linguistici a livello di Unione per la conformità normativa nel settore Life Science
I requisiti linguistici a livello di Unione sono di tipo generale. Fondamentalmente, tutti i prodotti di consumo commercializzati nell'UE sono soggetti al GPSR (General Product Safety Regulation). Il GPSR richiede che questi articoli siano forniti nelle lingue ufficiali, come stabilito dagli Stati membri in cui i prodotti sono resi disponibili:
- Istruzioni per l'utente
- Informazioni sull'etichettatura
- Documentazione per i prodotti di consumo
Per i prodotti soggetti a requisiti aggiuntivi di sicurezza e prestazioni, come i dispositivi medici e i prodotti farmaceutici, i requisiti linguistici vanno oltre l'etichetta e le informazioni fornite con il prodotto. Si applicano, ad esempio, quando il produttore è responsabile di assicurare un linguaggio conciso, chiaro o locale a supporto della sicurezza e delle prestazioni dei dispositivi. I requisiti linguistici a livello di Unione non determinano quali lingue nazionali specifiche siano necessarie per i singoli Stati membri.
Requisiti linguistici di livello nazionale
Le Autorità Nazionali Competenti (ANC) stabiliscono quali lingue nazionali specifiche sono richieste per ogni tipo di informazione per i dispositivi o i farmaci nei rispettivi mercati. In genere, tutti i contenuti destinati ai pazienti devono essere disponibili nelle lingue locali in tutti gli Stati membri, per garantire la sicurezza del paziente. Tuttavia, le autorità degli Stati membri considerano anche altri aspetti della comunicazione, come ad esempio:
- Livelli di alfabetizzazione dei lettori
- Conoscenze tecniche/mediche
- Formazione
Le autorità nazionali competenti nell'UE hanno opinioni differenti sul fatto che l'inglese sia o meno da considerare una lingua comunemente compresa e nel ritenere accettabile l'uso dell'inglese per i contenuti destinati ai professionisti. In alcuni Stati membri, come la Francia, l'Italia e gli Stati membri dell'Europa orientale, tra cui Bulgaria, Ungheria e Lituania, questo contenuto deve essere in lingua locale:
- Marketing
- Notifiche relative alla sicurezza sul campo
- Certificazione
L'inglese è accettato come esenzione in alcuni altri Paesi, come gli Stati membri del Nord Europa Danimarca e Svezia.
Requisiti linguistici a livello di prodotto
I requisiti a livello di prodotto includono casi d'uso unici per determinati dispositivi o farmaci, ad esempio un dispositivo diagnostico in vitro destinato all'autodiagnosi o al test vicino al paziente o un'applicazione mobile utilizzata per acquisire i dati del paziente.
I produttori devono considerare il contesto specifico di utilizzo del dispositivo o del farmaco per determinare le esigenze linguistiche nei casi in cui le pubblicazioni a livello di Unione o nazionale non definiscano regole sufficientemente specifiche. In caso di dubbio, i nostri esperti di soluzioni normative globali raccomandano di consultare l'Organismo Notificato o le Autorità Nazionali Competenti prima di immettere un dispositivo o un farmaco sul mercato o negli studi clinici.
La lingua guida l'accesso, la sicurezza e la trasparenza
I produttori e gli sponsor dei trial clinici devono rispettare le normative linguistiche previste per il settore Life Science per poter operare nel mercato dell'UE. Tuttavia, le considerazioni linguistiche non devono essere considerate come un semplice adempimento burocratico. Rendere disponibili le informazioni nelle lingue locali dell'UE è fondamentale per rendere le informazioni accessibili, leggibili e trasparenti per tutti gli utenti del prodotto o i volontari della sperimentazione. Inoltre, le traduzioni di alta qualità e l'attenzione alle sfumature culturali aiutano i produttori a espandere la loro presenza sul mercato e a garantire che i loro prodotti siano utilizzati in modo sicuro.
Contattateci
Siete in difficoltà con i requisiti linguistici per i contenuti regolamentati nel mercato multilingue dell'Unione europea? Collabori con Lionbridge per le soluzioni normative nell'UE. Abbiamo decenni di esperienza in ambito di requisiti linguistici e normative dell'UE per dispositivi medici e farmaci. Le nostre soluzioni in ambito normativo forniscono supporto per tutte le fasi del prodotto con servizi linguistici e di traduzione per il settore Life Science.
Compilate il modulo di contatto per parlare con i nostri consulenti.
Saremo felici di analizzare le vostre esigenze e mostrarvi come le nostre soluzioni innovative possono aiutarvi a superare ogni confine ed espandere la vostra portata globale. Siete pronti per scoprire tutte le possibilità? Siamo qui per aiutarvi.