
- リソース
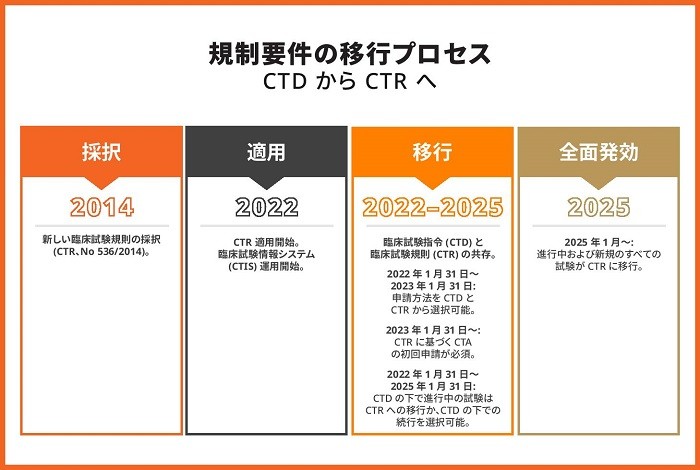
2014 年に臨床試験規則 (CTR) が採択され、欧州地域における臨床試験を取り巻く規制の状況は根本的に変化しました。臨床試験指令 (CTD) が廃止された 2022 年 1 月 31 日から 3 年間の移行期間も 2024 年に終わりを迎え、2025 年 1 月 31 日には CTR が全面的に発効します。進行中の臨床試験も、被験者の最終来院が 2025 年 1 月 30 日より後に予定されている場合は、EudraCT から臨床試験情報システム (CTIS) への移行が必要となります。移行後は CTR の下で臨床試験の規模が拡大し、コンテンツの分量も増えるため、臨床試験の依頼者にとっては臨床試験の言語戦略が非常に重要なものとなるでしょう。ここでは CTR の下で生じる可能性がある言語面の課題と、AI を活用してそうした課題に対処する方法をご紹介します。
混乱から洗練へ
CTR の導入は、EU 地域における多地域共同臨床研究を増やすことを目的としたものです。この改革により一時的に混乱と負担の増加が生じましたが、EU 全域で要件を統一して臨床試験を最適な方法で実施するという大きな目標の下、新たな制度が導入されるに至りました。臨床試験情報システム (CTIS) の運用により、臨床試験の申請手続きは EU 全域で効率が向上することが見込まれます。また、1 回の申請ですべての対象加盟国における合同審査が行われるようになる可能性もあります。情報提供依頼 (RFI) による延長期間を除き、新しい手続きは現在の標準である 60 日から 45 日に期間が短縮されます。
加えて、EU 全域での臨床試験指令から臨床試験規則への規制の移行により、加盟国間で技術要件が統一されます。その結果、臨床試験の承認と実施が効率化され、依頼者、患者、規制当局それぞれにメリットがもたらされます。また、CTIS のインターフェイスは公開されているため、地域の臨床研究の透明性が高まり、患者や被験候補者は地域の臨床試験の情報にアクセスできるようになります。
CTR の目的 (欧州医薬品庁の説明):
「EU においてイノベーションと研究を促進し、複数の EU 加盟国/EEA 参加国にまたがる、より大規模な臨床試験を実施しやすくする」
CTIS のメリット (欧州医薬品庁の説明):
- 「依頼者は 1 回のオンライン申請により、最大 30 か国の欧州諸国で臨床試験の承認を申請できる。
- 各国の規制当局が連携して、複数国における臨床試験の申請処理、追加情報の提供依頼、試験の承認/却下、承認された試験の監督を行うことができる。
- 他の EEA 参加国に試験を拡大しやすくなる。
- 検索可能な公開 Web サイトを通じて、EEA で実施された臨床試験の情報について、透明性と関係当事者によるアクセスが確保される」
多地域共同臨床試験に平均 6 か国の加盟国が参加
2022 年の CTIS の運用開始以来、現在までに 3,657 件の臨床試験が申請されています。2024 年 1 月だけでも、309 件の臨床試験申請 (CTA) が提出されました。そのうち 170 件は初回 CTA であり、多地域共同臨床試験で最も高い割合を占めていたのは商用臨床試験です。2024 年 1 月までに、CTIS で 1,144 件の多地域共同臨床試験について決定が下されましたが、それらの試験に参加する加盟国数の平均は 6 か国でした。こうした臨床試験の申請書類には常に、対象 EU 加盟国の現地語で示す必要がある内容が含まれるため、その翻訳が必要になります。以下に、2022 年 1 月以降に提出された多地域共同臨床試験の初回 CTA の内訳を示します。

AI ソリューション: AI を活用した言語戦略の拡大と迅速な導入
目論見どおり CTR により欧州連合で実施される臨床試験が増加した場合、臨床試験申請や国内レビュー (ICR) を管理する臨床試験スタッフや臨床試験予算における言語面の負担はますます大きくなるでしょう。また、臨床試験の準備段階で言語に関する計画を慎重に行い、すべての言語で以下に対応できるようにすることも必要になります。
- CTIS を通じた同時申請
- 規制当局の審査が行われる限られた期間中の更新作業
この制度は「暗黙の決定」を原則としており、依頼者が加盟国の規制当局からの情報提供依頼に対して期限内に回答しなかった場合、すべての対象加盟国でその申請は無効になります。
大規模言語モデル (LLM) とライフ サイエンス AI サービスには、大量のコンテンツ間で言語の一貫性を確保しながら、臨床試験関連の翻訳を大幅に迅速化できる可能性があります。現在、LLM の出力品質は急速に向上しています。臨床試験の依頼者が AI ソリューションからメリットを得ることができるのは、LLM を活用した強力な言語戦略と、前もって設定した一定レベルの人間の介入を組み合わせた場合です (この場合、リスクも軽減できます)。こうした戦略は以下の図のように、より多くのレベルで計画することができます。

お問い合わせ
ライフ サイエンス翻訳に関する戦略立案のサポートや、ライフ サイエンス分野向けの AI ソリューションをお求めでしたら、ぜひライオンブリッジにご相談ください。当社は過去数十年にわたって臨床試験関連翻訳のサービスをさまざまなお客様にご提供してきた実績があり、その中で多くの専門知識を蓄積してきました。下記のフォームからお問い合わせいただければ、ライフ サイエンス業界に特化した言語サービス プロバイダーである当社の担当者が詳しくご説明させていただきます。




