- 제공 서비스

- 산업 분야

- 리소스

- 라이온브리지 소개

제공 서비스 홈
생성형 AI
- AI 번역 서비스
- 콘텐츠 리믹스
AI 학습
- Aurora AI Studio™
기계번역
- MT 추적 도구
Smart Onboarding
번역 서비스 모델
콘텐츠 서비스
- 기술문서 작성
- 교육 및 이러닝
- 재무 보고서
- 디지털 마케팅
- 검색엔진 최적화(SEO) 및 콘텐츠 최적화
번역 서비스
- 동영상 로컬라이제이션
- 소프트웨어 로컬라이제이션
- 웹사이트 로컬라이제이션
- 규제 관련 기업을 위한 번역
- 통역
- 라이브 이벤트
- 언어 품질관리 서비스
테스트 서비스
- 기능 QA 및 테스트
- 호환성 테스트
- 상호 운용성 테스트
- 성능 테스트
- 접근성 테스트
- UX/CX 테스트
인사이트
- 블로그
- 사례연구
- 백서
- 솔루션 요약
- 인포그래픽
- 전자책
- 동영상
웨비나
라이온브리지 지식 허브
- 긍정적인 환자 결과
- 현대 임상시험 솔루션
- 환자 참여
- AI 사고의 리더십
언어 선택:
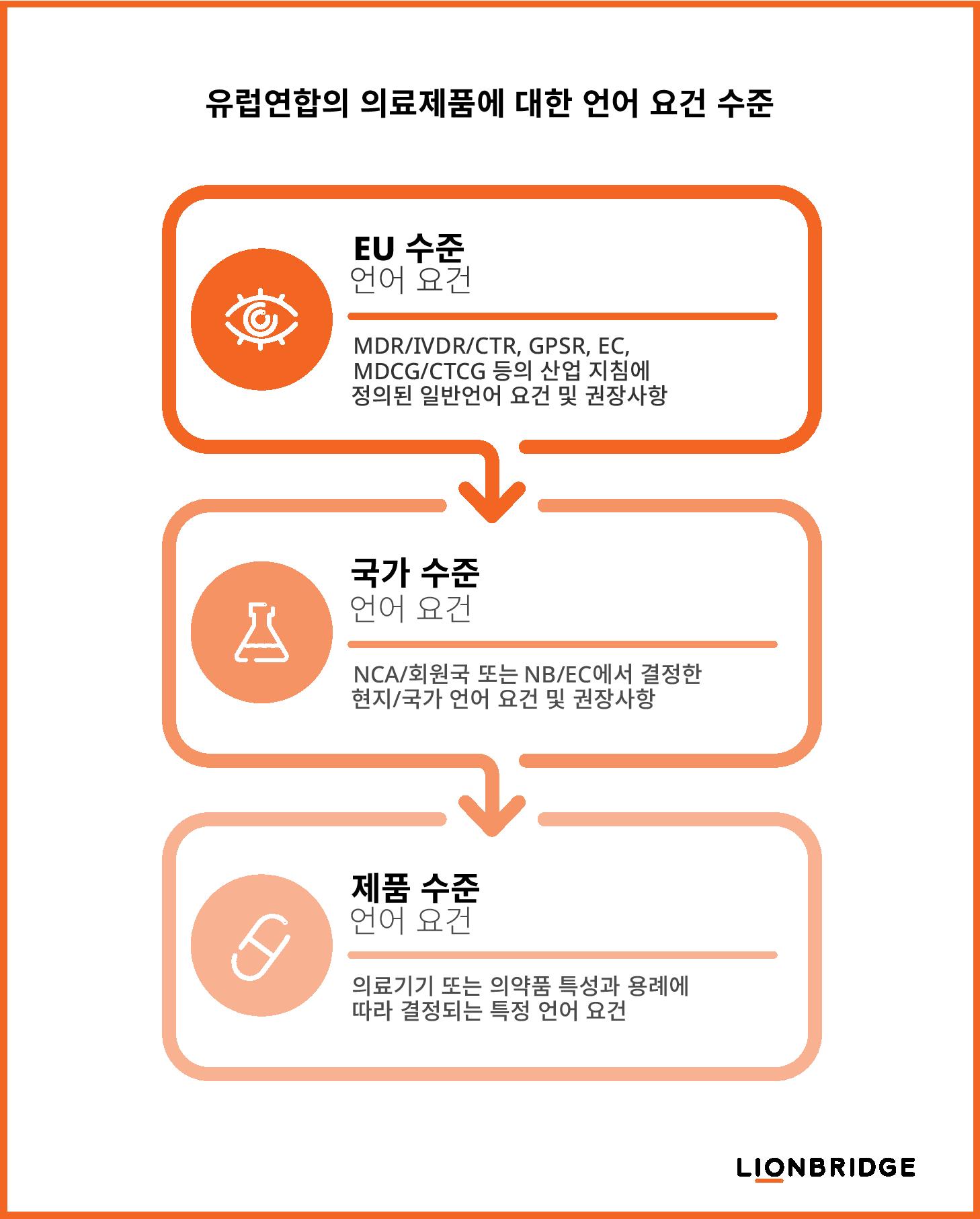
EU의 규제 번역 요건 결정
EU 의료기기 및 임상시험 규정에 따라 제조업체와 임상시험의뢰자는 다음 세 가지 수준의 언어 요건을 고려해 생명과학 규정을 준수해야 합니다.
EU 수준의 요건: MDR/IVDR/CTR, 일반제품안전규정(GPSR), 유럽위원회(EC) 간행물 및 의료기기 조정그룹(MDCG) 또는 임상시험 조정그룹(CTCG)에서 발행한 산업 지침 문서에 정의되어 있습니다.
국가 수준의 요건: 각 회원국의 국가 관할 당국(NCA)에서 결정되며, 의료기기의 적합성 평가 절차의 일환으로 인증기관(NB)에서 부분적으로 시행하거나, 임상시험 승인 절차의 일환으로 윤리위원회(EC)에서 부분적으로 시행합니다.
제품 수준의 요건: 사용 상황, 제품 특성, 의도한 사용자나 사용 목적 등 구체적인 제품 고려사항에 따라 결정됩니다.
생명과학 규정 준수를 위한 EU 수준의 언어 요건
EU 수준의 언어 요건은 일반적인 성격을 지닙니다. 기본적으로 EU에서 판매되는 모든 소비자 제품은 일반제품안전규정(GPSR)의 적용을 받습니다. GPSR에 따라 다음 항목은 제품이 판매되는 회원국에서 결정한 공식 언어로 제공해야 합니다.
- 사용자 지침
- 라벨 정보
- 소비자 제품 관련 자료
의료기기, 의약품과 같이 안전성 및 성능 요건이 추가로 적용되는 제품의 경우, 제품과 함께 제공되는 라벨 및 정보 외에 다른 항목도 언어 요건을 충족해야 합니다. 예를 들어, 제조업체가 의료기기의 안전성과 성능을 뒷받침할 수 있도록 간결하고 이해하기 쉬운 표현을 쓰거나 현지 언어를 사용해야 할 때 언어 요건이 적용됩니다. EU 수준의 언어 요건에는 각 회원국에서 어떤 국가의 언어를 사용해야 하는지 지정되어 있지 않습니다.
국가 수준의 언어 요건
국가 관할 당국(NCA)은 자국 시장에서 판매될 의료기기 또는 의약품의 각종 정보를 어떤 국가의 언어로 제공할 것인지 결정합니다. 일반적으로 환자에게 제공되는 모든 콘텐츠는 환자의 안전을 보장하기 위해 각 회원국의 현지 언어로 이용할 수 있어야 합니다. 그러나 회원국 당국은 다음과 같이 의사소통의 다른 측면도 고려합니다.
- 독자의 문해력 수준
- 기술/의학적 지식
- 숙련도
EU의 여러 국가 관할 당국은 영어로 일반적인 소통이 가능한지, 전문가 대상의 콘텐츠가 영어로 허용되는지를 고려해 각기 다른 요건을 적용합니다. 이에 따라 프랑스, 이탈리아를 비롯해 불가리아, 헝가리, 리투아니아를 포함한 동유럽 국가 등 일부 회원국에서는 아래의 콘텐츠를 현지 언어로 작성해야 합니다.
- 마케팅
- 현장 안전성 보고
- 인증
북유럽 회원국인 덴마크, 스웨덴 같은 일부 국가에서는 영어가 허용됩니다.
제품 수준의 언어 요건
제품 수준의 요건에는 특정 의료기기나 의약품의 고유한 사용 사례가 포함됩니다. 예를 들어, 자가검사나 현장검사용 체외진단기기, 환자 데이터를 수집하는 데 사용되는 모바일 애플리케이션이 있습니다.
EU나 국가 수준의 간행물에 언어 요건이 제대로 명시되지 않은 경우, 제조업체는 의료기기나 의약품이 사용되는 구체적인 상황을 고려하여 언어 요건을 결정해야 합니다. 당사의 글로벌 규제 솔루션 전문가는 요건이 확실하지 않으면 의료기기 또는 의약품을 시판하거나 임상시험을 시작하기 전에 인증기관이나 국가 관할 당국에 문의할 것을 권고합니다.
언어를 통한 접근성, 안전성, 투명성 제고
EU 시장에 진출하려는 제조업체와 임상시험의뢰자는 언어 요건을 충족해 생명과학 규정을 준수해야 합니다. 하지만 언어적 고려사항은 준수해야 할 규정을 나열한 단순한 체크리스트가 아닙니다. 제품 사용자 또는 임상시험 참여자 누구나 쉽게 접근할 수 있고, 읽고 이해할 수 있으며, 투명성이 확보된 정보를 만들기 위해서는 EU 현지의 언어로 정보를 제공해야 합니다. 또한 문화적 뉘앙스를 이해하고 우수한 번역을 제공하면 제조업체가 시장에서 입지를 확대하고 자사 제품이 안전하게 쓰이도록 만드는 데 도움이 됩니다.
문의하기
다양한 언어가 통용되는 EU에서 언어 규제로 인해 어려움을 겪고 계시나요? 라이온브리지(Lionbridge)와 함께 EU 규제에 대응할 방안을 마련해 보세요. 라이온브리지는 의료기기 및 의약품에 적용되는 EU 언어 및 EU 규정과 관련해 수십 년간 경험을 쌓아왔습니다. 당사의 규제 솔루션은 생명과학 번역 및 언어서비스를 통해 제품 수명주기의 모든 단계를 지원합니다.
문의 양식을 작성하여 상담을 받아보세요
라이온브리지는 고객의 니즈를 파악하고 혁신적인 성능을 통해 장벽을 허물고 전 세계로 진출하는 방법을 공유할 준비가 되어 있습니다. 새로운 가능성을 탐색할 준비가 되셨나요? 라이온브리지가 도와드리겠습니다.