- VAD VI GÖR
Ytterligare tjänster

- Branscher

Fallstudie: Flerspråkiga kampanjer i detaljhandeln
Nya AI-baserade lösningar för skapande av innehåll hos stort sport- och klädföretag

- RESURSER

- OM OSS

Startsida: Vad vi gör
Generativ AI
– AI-översättningstjänster
– Content Remix
AI-träning
– Aurora AI Studio™
Maskinöversättning
– Lionbridges bedömningsverktyg för MT
Smart onboarding
Tjänstemodeller för översättning
Innehållstjänster
– Teknisk dokumentation
– eLearning och utbildning
– Finansiella rapporter
– Digital marknadsföring
– SEO och innehållsoptimering
Översättningstjänster
– Videolokalisering
– Lokalisering av programvara
– Lokalisering av webbplatser
– Översättning för reglerade företag
– Tolkning
– Liveevenemang
– Language Quality Services
Testningstjänster
– Funktionstestning av spel
– Kompatibilitetstestning
– Interoperabilitetstestning
– Prestandatestning
– Tillgänglighetstestning
– Testning av användargränssnitt och kundupplevelse
Startsida: Branscher
Översättning för Life Sciences
– Översättning för läkemedelsindustrin
– Översättning för kliniska prövningar
– Regulatoriska översättningar
– Översättning efter godkännande
– Översättning för läkemedelsindustrin
– Språktjänster för medicintekniska produkter
– Validering och kliniska undersökningar
– Regulatoriska översättningar
– Översättning efter godkännande
– Översättning för tillverkare av medicintekniska produkter
Bank och finans
Detaljhandel
Lyxprodukter
E-handel
Lionbridge Games
Fordonsindustri
Konsumentförpackade varor
Teknik
Tillverkningsindustri
Juridiska tjänster
Resor, hotell och restaurang
Insikter
– Blogginlägg
– Fallstudier
– Faktablad
– Lösningsöversikter
– Infografik
– e-böcker
– Videor
Webbinarier
Lionbridges kunskapscenter
– Positiva patientutfall
– Moderna lösningar för kliniska prövningar
– Patientengagemang
- Tankeledarskap inom AI
VÄLJ SPRÅK:
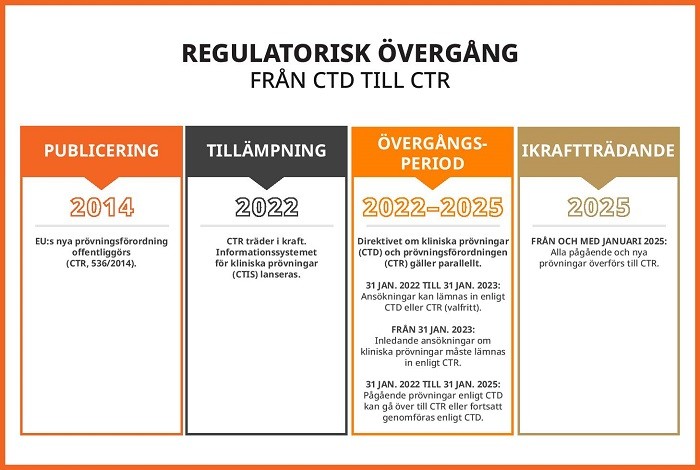
År 2014 offentliggjordes EU:s förordning för kliniska prövningar (CTR) som skrev om regelboken för kliniska prövningar i Europa. År 2024 markerar också slutet på den tre år långa övergångsperioden från direktivet för kliniska prövningar (CTD), som upphävdes den 31 januari 2022. Den 31 januari 2025 träder CTR i kraft fullt ut. Pågående prövningar där det sista patientbesöket är inbokat efter den 30 januari 2025 är ålagda att övergå från EudraCT till det nya informationssystemet för kliniska prövningar (CTIS). Efter övergången kommer prövningssponsorer att inse behovet av att införa en språkstrategi för kliniska prövningar enligt CTR, eftersom prövningarna blir större och innehållsvolymen ökar. Läs vidare för att lära dig mer om potentiella språkutmaningar med CTR och hur AI kan hjälpa dig att hantera dem.
Från störningar till storslagna resultat
CTR införs för att stärka den multinationella kliniska forskningen i EU. Trots att reformen inledningsvis medför störningar och ökad arbetsbelastning, införs förändringarna med en tydlig ambition om att harmonisera kraven och optimera genomförandet av kliniska prövningar i hela EU. I och med införandet av ett informationssystem för kliniska prövningar (CTIS) kommer ansökningsprocessen för kliniska prövningar att bli mer effektiv i hela EU. Det kommer också att finnas möjlighet att lämna in en enda ansökan och få den gemensamt bedömd av alla berörda medlemsländer. Den nya proceduren innebär att standarden förkortas från 60 till 45 dagar – ej inräknat förlängningsperioder för begäran om information (RFI).
Genom att direktivet i stället blir en EU-förordning kan dessutom de tekniska kraven harmoniseras mellan medlemsländer. Det ska leda till att prövningar kan godkännas och genomföras på ett mer effektivt sätt, vilket gagnar såväl sponsorer som patienter och tillsynsmyndigheter. Det offentliga gränssnittet i CTIS ger även ökad insyn i regional klinisk forskning och ger patienter och potentiella prövningsdeltagare tillgång till information om kliniska prövningar i regionen.
Enligt Europeiska läkemedelsmyndigheten (EMA) är syftet med prövningsförordningen att
”... främja innovation och forskning i EU och underlätta genomförandet av större kliniska prövningar i flera EU/EEA-länder”.
Enligt Europeiska läkemedelsmyndigheten (EMA) är fördelarna med CTIS att
- ”... sponsorer kan ansöka om godkännande av en klinisk prövning i upp till 30 EU-länder genom en enda onlineansökan
- nationella tillsynsmyndigheter kan samarbeta vid behandling av ansökningar om kliniska prövningar i flera länder, begära mer information, godkänna eller underkänna en prövningsansökan samt utöva tillsyn av godkända prövningar
- förenkla utökning av prövningar till andra EEA-länder
- en sökbar, offentlig webbplats underlättar insyn och tillgång till information för parter som är intresserade av kliniska prövningar som genomförs i EEA-området”.
Multinationella prövningar genomförs i genomsnitt i sex EU-länder
Sedan CTIS lanserades 2022 har 3 657 ansökningar om kliniska prövningar lämnats in. Enbart i januari 2024 lämnades 309 ansökningar om kliniska prövningar (CTA) in. Av dessa var 170 inledande ansökningar om kliniska prövningar, samtidigt som kommersiella kliniska prövningar står för den största andelen multinationella prövningar. I januari 2024 hade 1 144 multinationella prövningar fått ett beslut i CTIS och i dessa prövningar var det genomsnittliga antalet EU-länder sex. I alla dessa prövningar behövs översättningar av innehåll till inlämningsdossier på de lokala officiella språken i EU-länderna. Nedan kan du se fördelningen av inledande ansökningar om multinationella kliniska prövningar som lämnats in sedan januari 2022.

AI-lösningar: Expansion och hastighet skapar behov av AI-baserade språkstrategier
Om CTR lyckas locka större kliniska prövningar till EU kommer språk att bli en större budgetpost och öka arbetsbördan för dem som hanterar ansökningar för kliniska prövningar och lokal granskning. Dessutom kräver språkaspekten noggrann planering när prövningar förbereds för att se till att alla språk är redo för
- samtidig inlämning via CTIS
- eventuella uppdateringar under de korta tidsfönstren för regulatorisk granskning.
Systemet bygger på en tyst beslutsprincip. Det innebär att om en sponsor inte besvarar en begäran om information från myndigheterna i ett medlemsland inom utsatt tid, löper ansökan ut för alla berörda länder.
Stora språkmodeller (LLM) och AI-tjänster för Life Sciences kan potentiellt snabba på översättningar för kliniska prövningar och samtidigt säkerställa att språket är konsekvent i stora innehållsvolymer. Det bör noteras att kvaliteten på LLM-resultat förbättras i snabb takt. Prövningssponsorer kan dra nytta av AI-lösningar genom att kombinera en tydlig språkstrategi med stora språkmodeller (LLM) med fördefinierade nivåer av manuella insatser. (Samtidigt minskar de också risken.) Sådana strategier kan utformas på fler nivåer, se våra förslag nedan.

Kontakta oss
Behöver du hjälp med att ta fram en strategi för din översättning för Life Sciences? Är du nyfiken på AI-lösningar för Life Sciences? Lionbridge har flera decenniers djupgående kunskap och expertis inom översättning för Life Sciences. Kontakta oss i dag för att få veta mer om Lionbridge som språktjänstleverantör inom Life Sciences.



