- VAD VI GÖR
Ytterligare tjänster

- Branscher

Fallstudie: Flerspråkiga kampanjer i detaljhandeln
Nya AI-baserade lösningar för skapande av innehåll hos stort sport- och klädföretag

- RESURSER

- OM OSS

Startsida: Vad vi gör
Generativ AI
– AI-översättningstjänster
– Content Remix
AI-träning
– Aurora AI Studio™
Maskinöversättning
– Lionbridges bedömningsverktyg för MT
Smart onboarding
Tjänstemodeller för översättning
Innehållstjänster
– Teknisk dokumentation
– eLearning och utbildning
– Finansiella rapporter
– Digital marknadsföring
– SEO och innehållsoptimering
Översättningstjänster
– Videolokalisering
– Lokalisering av programvara
– Lokalisering av webbplatser
– Översättning för reglerade företag
– Tolkning
– Liveevenemang
– Language Quality Services
Testningstjänster
– Funktionstestning av spel
– Kompatibilitetstestning
– Interoperabilitetstestning
– Prestandatestning
– Tillgänglighetstestning
– Testning av användargränssnitt och kundupplevelse
Startsida: Branscher
Översättning för Life Sciences
– Översättning för läkemedelsindustrin
– Översättning för kliniska prövningar
– Regulatoriska översättningar
– Översättning efter godkännande
– Översättning för läkemedelsindustrin
– Språktjänster för medicintekniska produkter
– Validering och kliniska undersökningar
– Regulatoriska översättningar
– Översättning efter godkännande
– Översättning för tillverkare av medicintekniska produkter
Bank och finans
Detaljhandel
Lyxprodukter
E-handel
Lionbridge Games
Fordonsindustri
Konsumentförpackade varor
Teknik
Tillverkningsindustri
Juridiska tjänster
Resor, hotell och restaurang
Insikter
– Blogginlägg
– Fallstudier
– Faktablad
– Lösningsöversikter
– Infografik
– e-böcker
– Videor
Webbinarier
Lionbridges kunskapscenter
– Positiva patientutfall
– Moderna lösningar för kliniska prövningar
– Patientengagemang
- Tankeledarskap inom AI
VÄLJ SPRÅK:
I ett tidigare blogginlägg diskuterade vi den flerspråkiga EU-marknaden och hur unionens flerspråkighetspolicy påverkar efterlevnad av regelverket för Life Sciences när det gäller språkkrav för regulatorisk översättning. Den här bloggen kommer att fördjupa sig i de tre nivåerna av språkkrav som dessa grupper måste känna till:
- Enhetstillverkare
- Ekonomisk aktör
- Prövningssponsor för medicintekniska produkter i EU
Fastställande av regulatoriska översättningsbehov i EU
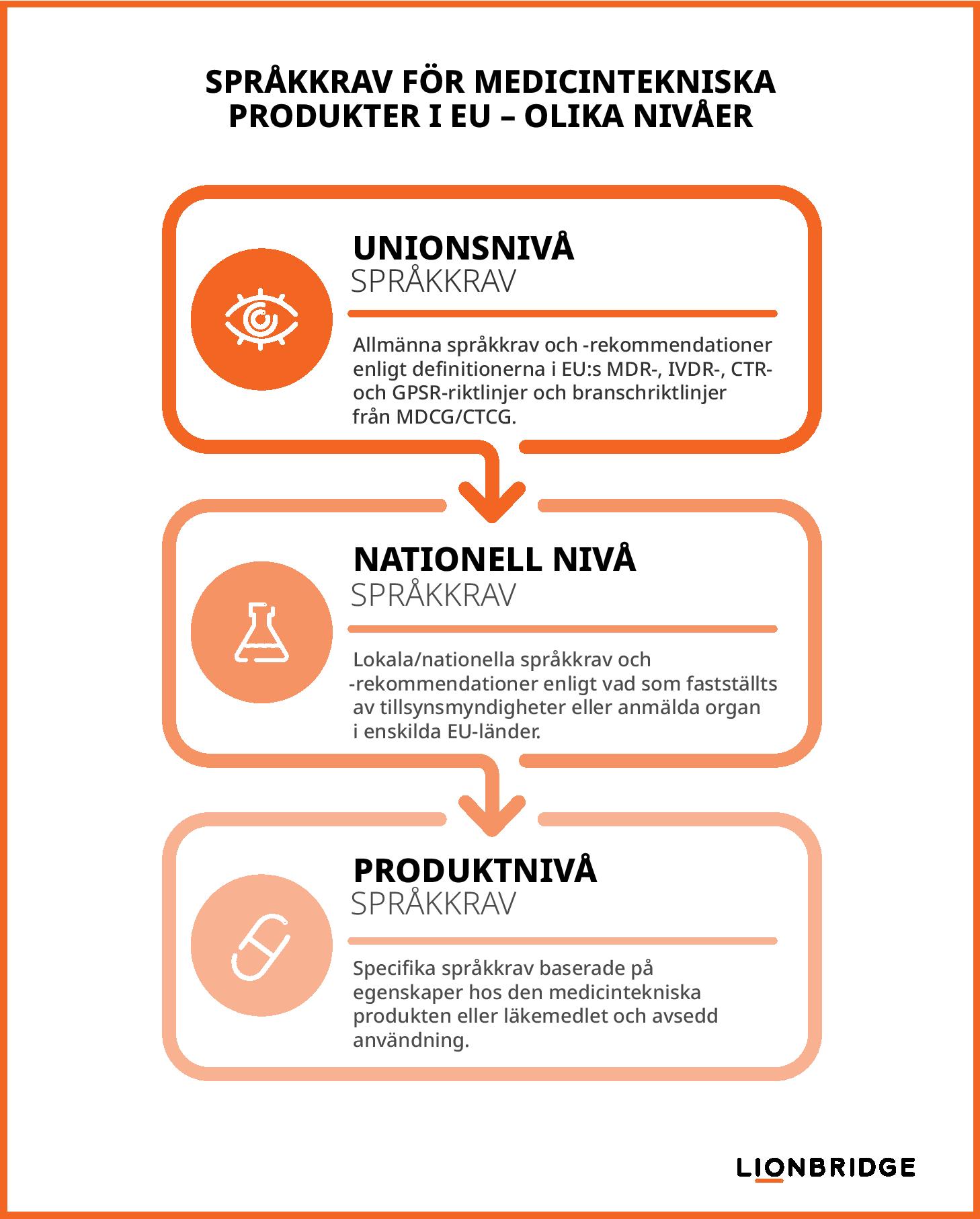
Enligt EU-förordningen om medicintekniska produkter och EU-förordningen om kliniska prövningar bör tillverkare och sponsorer av kliniska prövningar ta hänsyn till följande tre nivåer av språkkrav för att säkerställa att regelverket för Life Sciences efterlevs:
Krav på unionsnivå: Definieras i MDR/IVDR/CTR, EU-förordningen om allmän produktsäkerhet (GPSR), publikationer utgivna av Europeiska kommissionen och riktlinjedokument för branschen utgivna av EU:s Medical Device Coordination Group (MDCG) och EU:s Clinical Trials Coordination Group (CTCG)
Krav på nationell nivå: Fastställs av enskilda medlemsländers nationella behöriga myndigheter (NBA) och upprätthålls delvis av anmälda organ som en del i bedömningsprocedurer för efterlevnad för medicintekniska produkter eller av etikkommittéer som en del i godkännandeprocedurer för kliniska prövningar.
Krav på produktnivå: Bestäms av specifika produktöverväganden, såsom användningskontext, produktegenskaper eller avsedda användare eller syften.
Språkkrav på unionsnivå för efterlevnad av regelverk för Life Sciences
Språkkraven på unionsnivå är generella. I princip omfattas alla konsumentprodukter som förekommer i EU av EU-förordningen om allmän produktsäkerhet (GPSR). Enligt GPSR ska följande tillhandahållas på det/de officiella språk som beslutas av medlemsländerna där produkterna marknadsförs:
- Användarinstruktioner
- Märkningsinformation
- Dokumentation för konsumentprodukter
För produkter som omfattas av ytterligare säkerhets- och prestandakrav, såsom medicintekniska produkter och läkemedel, sträcker sig språkkraven längre än etiketten och informationen som medföljer produkten. De gäller till exempel när tillverkaren ansvarar för att information tillhandahålls i kortfattad och klarspråklig form eller på lokala språk för att produkter ska kunna användas och fungera på ett säkert sätt. Språkkrav på unionsnivå avgör inte vilka specifika nationella språk som krävs per enskild medlemsstat.
Språkkrav på nationell nivå
Nationella behöriga myndigheter beslutar om vilket eller vilka nationella språk som krävs för olika typer av information om medicintekniska produkter eller läkemedel på sina respektive marknader. I allmänhet måste allt innehåll avsett för patienter finnas tillgängligt på lokala språk i varje medlemsstat för att garantera patientsäkerheten. Medlemsstaternas myndigheter överväger dock även andra aspekter av kommunikation, såsom:
- Läsarnas läskunnighetsnivåer
- Teknisk/medicinsk kunskap
- Utbildning
Nationella behöriga myndigheter i EU har olika syn på huruvida engelska är ett språk som förstås av allmänheten och huruvida innehåll avsett för professionella användare är godtagbart på engelska. I vissa medlemsstater, som Frankrike, Italien och flera östeuropeiska medlemsstater, inklusive Bulgarien, Ungern och Litauen, måste detta innehåll vara på det lokala språket:
- Marknadsföring
- Fältsäkerhetsmeddelanden
- Certifiering
Engelska accepteras som undantag i ett fåtal andra länder, till exempel Sverige och Danmark.
Språkkrav på produktnivå
Krav på produktnivå ställs i exempelvis unika användningsfall för vissa medicintekniska produkter och läkemedel, till exempel in vitro-diagnostikutrustning avsedd för självtestning eller patientnära testning eller en mobilapp som används för att samla in patientdata.
Tillverkare bör utgå från det aktuella sammanhanget för användning av medicintekniska produkter eller läkemedel för att fastställa språkbehoven i fall då publikationer på unionsnivå eller nationell nivå inte behandlar det i tillräcklig utsträckning. Om du är osäker rekommenderar våra experter på globala regulatoriska lösningar att du konsulterar det anmälda organet eller de nationella behöriga myndigheterna innan du släpper ut en enhet eller ett läkemedel på marknaden eller i kliniska studier.
Språk driver åtkomst, säkerhet och transparens
För att få tillgång till EU-marknaden behöver tillverkare och sponsorer av kliniska prövningar säkerställa att språkkraven i regelverk för Life Sciences är uppfyllda. Språkliga överväganden handlar dock inte bara om att uppfylla regelverk. Att göra information tillgänglig på lokala EU-språk är avgörande för att göra information tillgänglig, läsbar och transparent för alla produktanvändare eller provvolontärer. Genom att tillhandahålla översättningar av hög kvalitet och ta hänsyn till kulturella nyanser kan tillverkare stärka sin marknadsnärvaro och se till att deras produkter används på ett säkert sätt.
Kontakta oss
Kämpar du med språkkraven för regulatoriskt innehåll i det flerspråkiga EU? Samarbeta med Lionbridge för regulatoriska lösningar i EU. Vi har flera decenniers erfarenhet av EU-språk och EU:s förordningar för medicintekniska produkter och läkemedel. Våra regulatoriska lösningar stödjer alla produktstadier med våra översättnings- och språktjänster inom Life Sciences.
Fyll i kontaktformuläret för att inleda ett samtal med oss.
Vi vill gärna sätta oss in i dina behov och berätta hur våra innovativa funktioner kan hjälpa dig att riva barriärer och utöka din globala räckvidd. Är du redo att utforska möjligheterna? Vi ser fram emot att hjälpa dig.