- VAD VI GÖR
Ytterligare tjänster

- Branscher

Fallstudie: Flerspråkiga kampanjer i detaljhandeln
Nya AI-baserade lösningar för skapande av innehåll hos stort sport- och klädföretag

- RESURSER

- OM OSS

Startsida: Vad vi gör
Generativ AI
– AI-översättningstjänster
– Content Remix
AI-träning
– Aurora AI Studio™
Maskinöversättning
– Lionbridges bedömningsverktyg för MT
Smart onboarding
Tjänstemodeller för översättning
Innehållstjänster
– Teknisk dokumentation
– eLearning och utbildning
– Finansiella rapporter
– Digital marknadsföring
– SEO och innehållsoptimering
Översättningstjänster
– Videolokalisering
– Lokalisering av programvara
– Lokalisering av webbplatser
– Översättning för reglerade företag
– Tolkning
– Liveevenemang
– Language Quality Services
Testningstjänster
– Funktionstestning av spel
– Kompatibilitetstestning
– Interoperabilitetstestning
– Prestandatestning
– Tillgänglighetstestning
– Testning av användargränssnitt och kundupplevelse
Startsida: Branscher
Översättning för Life Sciences
– Översättning för läkemedelsindustrin
– Översättning för kliniska prövningar
– Regulatoriska översättningar
– Översättning efter godkännande
– Översättning för läkemedelsindustrin
– Språktjänster för medicintekniska produkter
– Validering och kliniska undersökningar
– Regulatoriska översättningar
– Översättning efter godkännande
– Översättning för tillverkare av medicintekniska produkter
Bank och finans
Detaljhandel
Lyxprodukter
E-handel
Lionbridge Games
Fordonsindustri
Konsumentförpackade varor
Teknik
Tillverkningsindustri
Juridiska tjänster
Resor, hotell och restaurang
Insikter
– Blogginlägg
– Fallstudier
– Faktablad
– Lösningsöversikter
– Infografik
– e-böcker
– Videor
Webbinarier
Lionbridges kunskapscenter
– Positiva patientutfall
– Moderna lösningar för kliniska prövningar
– Patientengagemang
- Tankeledarskap inom AI
VÄLJ SPRÅK:
Det här är en del i vår serie om patientengagemang där Lionbridges Life Sciences-experter diskuterar historiska och nuvarande förhållanden för deltagare i kliniska studier och patienter i sjukvårdssystemet.
2021 blev Lionbridge företagsmedlem i European Forum for Good Clinical Practice (EFGCP) tack vare vårt engagemang för transparent och tillgänglig kommunikation inom Life Sciences-branschen och patientgrupper.
Lionbridges chef för Regulated Life Sciences Solutions Portfolio Pia Windelov intervjuade nyligen styrelseordföranden för EFGCP, Ingrid Klingmann.
Under den här frågestunden fokuserar vi på betydelsen av kommunikation och klarspråk inom klinisk forskning för ett antal berörda parter inom hälso- och sjukvårdssektorn.
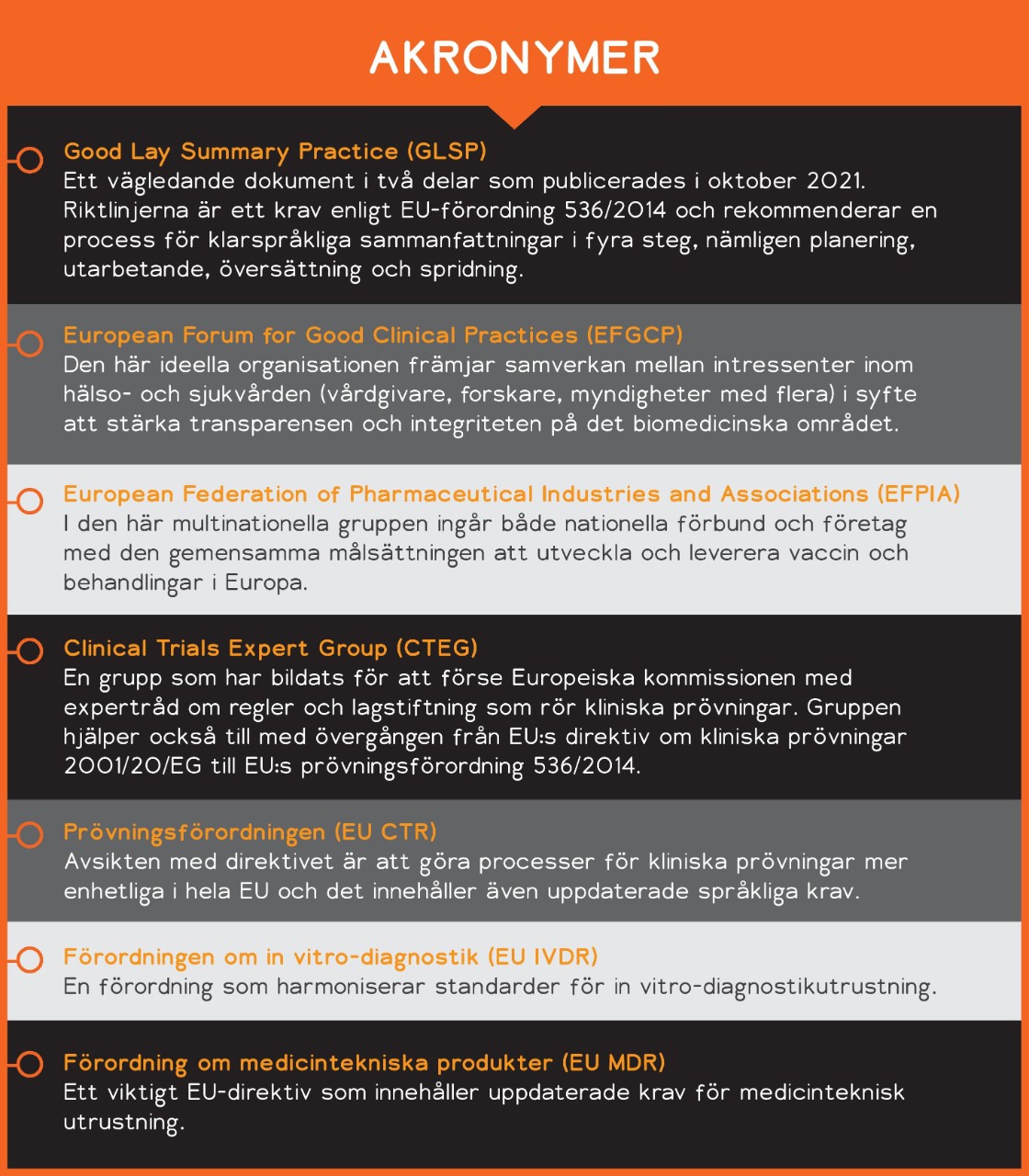
Pia: Välkommen Ingrid, stort tack för att du kom hit. Vi på Lionbridge är väldigt glada över vårt samarbete med EFGCP eftersom vi båda engagerat strävar efter att implementera öppen och effektiv kommunikation inom patientgrupper, Life Sciences-branschen, etikkommittéer och tillsynsmyndigheter. Du och jag har redan haft nöjet att arbeta tillsammans med initiativet Roadmap Initiative to Good Lay Summary Practice (GLSP). Under EFGCP:s och EFPIA:s ledning tog vi fram rekommendationer för ett flertal berörda parter om hur man utarbetar klarspråkliga sammanfattningar av resultat från kliniska prövningar enligt den nya Prövningsförordningen (EU). Den 4 oktober publicerades GLSP i volym 10 av EudraLex som en riktlinje för kliniska prövningar vilken antagits av Europeiska kommissionens expertgrupp för kliniska prövningar.
Kan du beskriva hur du föreställer dig EFGCP:s roll och uppdrag när det gäller resultatkommunikation och öppenhet inom klinisk forskning, hos tillsynsmyndigheter och i patientgrupper?
Ingrid: Öppenhet när det gäller resultat från kliniska prövningar kommer endast att förbättras på ett meningsfullt sätt om det är praktiskt genomförbart att ta fram och sprida klarspråkliga sammanfattningar. Det måste vara enkelt att kunna hitta och förstå informationen för både patienter och allmänheten. Över 60 organisationer har gått samman i initiativet ”Roadmap Initiative to Good Lay Summary Practice” (GLSP) som svar på samstämmigheten gällande behovet av en konkret och global infrastruktur för utarbetande och spridning av klarspråkliga sammanfattningar som vänder sig till patienter. Tillsammans representerar gruppen alla berörda parter.
Gruppen började med att samla in och diskutera befintlig sakkunskap om klarspråkliga sammanfattningar. Sedan utvecklade vi gemensamt de bäst lämpade metoderna som kommer att presenteras i en snabbguide och en handbok som förenklar det som kommer att bli ett lagstadgat krav när Prövningsförordningen börjar gälla den 31 januari 2022. I samarbete med expertgruppen för kliniska prövningar (CTEG), som tillhör den Europeiska kommissionens generaldirektorat för folkhälsa och livsmedelssäkerhet, har dessa rekommendationer nu blivit en del av det regelverk för kliniska prövningar som presenteras i volym 10 av EudraLex.
Detta var endast det första steget mot att möjliggöra en tillförlitlig öppenhet om resultat av kliniska prövningar. Det är lika viktigt att dessa rekommendationer införs i branschens och akademiska sponsorers arbetsrutiner samt inom grupper för patientengagemang.
Initiativet Roadmaps medlemsorganisationer beslutade dessutom att gemensamt påbörja spridningsfasen under ledning av EFGCP och EFPIA. Detta innebär att vi kommer att ta fram och utföra en arbetsplan för att i så stor utsträckning som möjligt öka kunskapen om den nya standarden. Vi kommer att organisera webbkonferenser och workshoppar för allmänheten och enskilda berörda grupper för att diskutera införandet av GLSP, eventuella utmaningar och områden som kan förbättras. Och vi kommer att utforma utbildningsprogram som är anpassade till olika berörda parters behov. Med stöd från våra amerikanska kollegor hoppas vi kunna ta initiativet till stora framsteg när det gäller insyn i resultat av kliniska prövningar.
PW: Lionbridge är en leverantör av språktjänster och språkteknik, och våra kunder vänder sig ofta till oss för att få branschspecifik vägledning om efterlevnad av språkkrav enligt de nya EU-reformerna om kliniska prövningar (EU CTR) och medicintekniska produkter (EU MDR och EU IVDR). Jag tror att de vänder sig till oss på grund av en allmän brist på vägledning från tillsynsmyndigheter, och på grund av att språk förblir en nationell angelägenhet som regleras av varje enskild medlemsstat. Tror du att vi kommer att få se mer vägledning, eller fler standarder, från tillsynsmyndigheter som kan hjälpa branschen i framtagandet och spridningen av kommunikation på klarspråk?
IK: Tillgång till information på nationalspråken är medlemsstaternas ansvar. Det är inte troligt att EU-kommissionen kommer att försöka reglera detta område utöver det tillvägagångssätt som presenteras i GLSP: om beslut måste fattas, t.ex. om deltagande i en klinisk prövning, måste informationen (i patientinformationsbladet) vara på ett språk som patienten kan förstå, och därför bör resultaten finnas tillgängliga på samma språk.

PW: Vilka utmaningar ser du med att utforma effektiv kommunikation utan försäljningssyfte om resultat av kliniska prövningar och prestandan hos medicintekniska produkter för deltagare i kliniska prövningar och allmänheten? Denna fråga måste vara aktuell för hela hälso- och sjukvårdssystemet på grund av de kommande EU-databaserna för kliniska prövningar och medicintekniska produkter som håller på att upprättas som en del av de nya regulatoriska EU-reformerna.
IK: Även om vi kan och har kommit fram till gemensamt antagna normer för innehållet i och utformandet av klarspråkliga sammanfattningar oroar vi oss för om dessa sammanfattningar når ut till patienterna och allmänheten. Överföring till EU-databasen är en lagstadgad skyldighet för prövningar av läkemedel respektive medicintekniska produkter. Det finns dock ingen definierad plats för sammanfattningar av resultat från alla andra typer av kliniska studier, och vi är inte säkra på att patienter och allmänheten i förbyggande syfte kommer att försöka söka efter resultat från prövningar av läkemedel och medicintekniska produkter i dessa komplicerade EU-databaser.
En annan utmaning är den korta förberedelseperiod som föreskrivs av den nya lagstiftningen. Detta kommer att göra det mycket svårt att utarbeta lättförståeliga sammanfattningar som är fullt ut lämpliga för sitt ändamål. Det bästa vore om patienter involverades i utformningen av sammanfattningar på klarspråk, och man bör dessutom utföra professionella användartester av originalversionen och översättningarna.
Den tredje punkten handlar om innehållet: Sammanfattningar på klarspråk bör presentera resultaten från den primära forskningsfrågan och från de sekundära forskningsmål som är relevanta för patienterna. Men hur bestämmer vi vad som är relevant för patienterna? Denna tvetydighet skapar en risk för att man ”plockar russinen ur kakan” och endast presenterar de fördelaktiga resultaten. Våra GLSP-rekommendationer ger råd om hur man kan undvika detta, men det finns ingen garanti för att sponsorer tillämpar dessa rekommendationer på ett tillförlitligt sätt.
”GLSP rekommenderar att sponsorer av prövningar börjar planera den klarspråkliga sammanfattningen och dess översättningar innan studien påbörjas och när prövningsprotokollet och patientinformationsbladet/blanketten för informerat samtycke utarbetas.”
PW: Det är allmänt erkänt att klarspråklig kommunikation avsedd för en icke-vetenskaplig publik, till exempel deltagare i kliniska prövningar, patienter och den breda allmänheten, är mest effektiv på lokalt språk eller modersmål. Som språktjänstleverantör stöter Lionbridge dock ofta på kunder som hanterar översättningar i sista minuten och med begränsade budgetanslag eller finansiering. Tror du att det här tillvägagångssättet kommer att ändras i framtiden, med tanke på att det fästs allt större vikt vid öppenhet och resultatkommunikation enligt EU:s nya regulatoriska reformer för kliniska prövningar och medicintekniska produkter?
IK: Jag befarar att detta kommer att fortsätta vara ett problem under en ganska lång tid framöver. GLSP rekommenderar att sponsorer av prövningar börjar planera den klarspråkliga sammanfattningen och dess översättningar innan studien påbörjas och när prövningsprotokollet och patientinformationsbladet/blanketten för informerat samtycke utarbetas. Detta för att i förväg säkerställa en överenskommelse om hur resultaten ska presenteras och att språket hanteras på samma sätt i patientinformationsbladet och den klarspråkliga sammanfattningen. En sådan tidig planering kommer att vara till hjälp när det gäller att hantera de mycket korta regulatoriska tidsfristerna för offentliggörande av resultat efter avslutad prövning. Men det är också en fråga om budget: Tidig planering borde skydda budgeten för den klarspråkliga sammanfattningen och dess översättningar. Detta kommer särskilt att vara en utmaning i prövningar som finansieras med offentliga medel, eftersom utarbetandet och spridningen av den klarspråkliga sammanfattningen kan ske långt efter att finansieringsperioden avslutats. Nuvarande finansieringssystem förutser inte finansiering av projektverksamhet efter slutet på projektperioden.
PW: Som EFGCP:s styrelseordförande har du ett nära samarbete med tillsynsmyndigheter, branschen, akademiska institutioner och patientgrupper. Var ser du framsteg, och var ser du samtidigt hinder, hos dessa olika intressenter när det gäller skapande av öppen kommunikation? Hur tror du att lättförståelig kommunikation kommer att utvecklas under de kommande åren?
IK: Stora läkemedelsföretag har redan etablerat ett arbetsförlopp för utvecklingen av klarspråkliga sammanfattningar av resultat från kliniska prövningar på vuxna, men i mindre utsträckning för resultat från pediatriska prövningar. Mindre företag och akademiska forskare kommer praktiskt taget att få börja från grunden. De har mycket begränsade erfarenheter och resurser för utarbetande, översättning och spridning av klarspråkliga sammanfattningar.
En av de viktigaste delarna i GLSP är att göra patienterna delaktiga i utarbetande-, översättnings- och spridningsprocessen. Den här aspekten är svår att uppnå när man har en mycket pressad tidsplan utan budget. Det rättsliga kravet på att ta fram och sprida klarspråkliga sammanfattningar som vänder sig till patienter är ett mycket bra skäl för att öka medvetenheten om behovet, och framför allt om fördelarna med tillförlitlig öppenhet om resultat, men det kommer att krävas en enorm internationell ansträngning från alla berörda grupper för att göra öppenhet om resultat till en rutinmässig tjänst för våra patienter och allmänheten.

PW: I arbetet med kunder inom den medicintekniska branschen och läkemedelsbranschen stöter Lionbridge regelbundet på kunder som rådfrågar oss om hur man genomför läsbarhetstester på lokalt språk för lättförståeliga sammanfattningar. Därför är det min uppfattning att det finns brister i den regulatoriska vägledningen för lämpliga läsbarhetsmetoder. Håller du med om den här iakttagelsen? Jag tycker att EU borde vara en föregångare när det gäller att skapa effektiva läsbarhetslösningar på grund av unionens många språk. Varför tror du att tillsynsmyndigheter kan ha begränsat fokus på läsbarhetstester, trots den Europeiska unionens flerspråkiga natur?
IK: Jag håller med, men jag tror inte att vi kommer att kunna lösa detta med hjälp av vägledning från EU. Den lämpligaste standarden för läsbarhetstester måste föreslås, diskuteras, avtalas och implementeras som ett resultat av samarbete mellan sponsorer och patientgrupper.
”Det kommer att krävas en enorm internationell ansträngning från alla berörda grupper för att göra öppenhet om resultat till en rutinmässig tjänst för våra patienter och allmänheten.”
PW: Patienter, deltagare i kliniska prövningar och vårdgivare söker i ökad utsträckning information på egen hand på grund av den allmänna tillgången till hälsorelaterad information och sociala plattformar där information delas fritt. Tror du att vi kommer att få se fler regulatoriska åtgärder för användningen av sociala medieplattformar och hur tillverkare av läkemedel och medicintekniska produkter delar med sig av information på dessa plattformar?
IK: Trots intensiva diskussioner och ett förslag från initiativet Roadmaps medlemmar ger den slutliga versionen av GLSP inte någon vägledning om hur man ska hantera spridning av klarspråkliga sammanfattningar genom sociala medieplattformar. Opinionsbildning och beslutsfattande bland tillsynsmyndigheter, etikkommittéer och sponsorer har ännu inte uppnått en nivå som skulle göra det möjligt att ge allmänna rekommendationer. Det finns många aspekter att ta hänsyn till. Nästa version av GLSP-rekommendationerna kan komma att omfatta detta ämne.
PW: Hälsokunskap är en utmaning i EU såväl som i andra delar av världen. Mitt intryck är dock att hälsokunskap och klarspråklig kommunikation fortfarande inte får så stor uppmärksamhet bland branschaktörer och tillsynsmyndigheter. Är det en korrekt observation och varför tror du att det är så?
IK: Att öka hälsokunskapen är en mycket långsiktig uppgift, eftersom den kräver att man ökar allmänhetens intresse för hälsofrågor. Coronaviruspandemin har visat oss att det är möjligt att göra stora framsteg när det gäller allmänhetens intresse. En stor del av allmänheten är plötsligt intresserade av nya vacciner och behandlingar av covid-19, hur de utvecklas och godkänns, vilka prövningar som har gjorts och vad resultaten av dem blev. Vi har sett hur viktigt det är att ha experter som kan förklara forskningen och dess resultat för allmänheten för att tillgodose informationsbehovet. När klarspråkliga sammanfattningar utarbetas, översätts och sprids i enlighet med den patientcentrerade GLSP-standarden kan de bli ett kraftfullt verktyg för att ge relevant information om alla typer av klinisk forskning åt en allt mer intresserad och kunnig publik.