- VAD VI GÖR
Ytterligare tjänster

- Branscher

Fallstudie: Flerspråkiga kampanjer i detaljhandeln
Nya AI-baserade lösningar för skapande av innehåll hos stort sport- och klädföretag

- RESURSER

- OM OSS

Startsida: Vad vi gör
Generativ AI
– AI-översättningstjänster
– Content Remix
AI-träning
– Aurora AI Studio™
Maskinöversättning
– Lionbridges bedömningsverktyg för MT
Smart onboarding
Tjänstemodeller för översättning
Innehållstjänster
– Teknisk dokumentation
– eLearning och utbildning
– Finansiella rapporter
– Digital marknadsföring
– SEO och innehållsoptimering
Översättningstjänster
– Videolokalisering
– Lokalisering av programvara
– Lokalisering av webbplatser
– Översättning för reglerade företag
– Tolkning
– Liveevenemang
– Language Quality Services
Testningstjänster
– Funktionstestning av spel
– Kompatibilitetstestning
– Interoperabilitetstestning
– Prestandatestning
– Tillgänglighetstestning
– Testning av användargränssnitt och kundupplevelse
Startsida: Branscher
Översättning för Life Sciences
– Översättning för läkemedelsindustrin
– Översättning för kliniska prövningar
– Regulatoriska översättningar
– Översättning efter godkännande
– Översättning för läkemedelsindustrin
– Språktjänster för medicintekniska produkter
– Validering och kliniska undersökningar
– Regulatoriska översättningar
– Översättning efter godkännande
– Översättning för tillverkare av medicintekniska produkter
Bank och finans
Detaljhandel
Lyxprodukter
E-handel
Lionbridge Games
Fordonsindustri
Konsumentförpackade varor
Teknik
Tillverkningsindustri
Juridiska tjänster
Resor, hotell och restaurang
Insikter
– Blogginlägg
– Fallstudier
– Faktablad
– Lösningsöversikter
– Infografik
– e-böcker
– Videor
Webbinarier
Lionbridges kunskapscenter
– Positiva patientutfall
– Moderna lösningar för kliniska prövningar
– Patientengagemang
- Tankeledarskap inom AI
VÄLJ SPRÅK:
Bedömningar av patientrapporterade utfall (PRO) har blivit värdefulla verktyg för att ta hänsyn till patientens upplevelse vid utveckling av medicinsk utrustning. PRO-data kan samlas in under produktens hela livscykel, från första utvecklingsstadiet till kliniska prövningar och observationsstudier. PRO:er kan ligga till grund för
- inkluderingskriterier
- baslinjebedömning
- effektivitetsbedömning
- säkerhetsbedömning i kliniska prövningar och/eller säkerhetsstudier efter godkännande.
Tillsynsmyndigheter som amerikanska FDA och europeiska EMA ser PRO:er som en del i den stora kategorin med ”patientupplevelsedata (PED)”. PED speglar patienters upplevelser, perspektiv, behov och prioriteringar under deras patientresa. Myndigheterna använde sina strategiska initiativ och vägledande dokument för att lyfta fram patientupplevelsedata som en viktig bidragande faktor vid produktutveckling och regulatoriska beslutsprocesser.
PED i regulatoriska beslutsprocesser
Fullständig överensstämmelse mellan tillsynsmyndigheter och industrin när det gäller användning av patientupplevelsedata är dock en målsättning som tar tid att uppfylla. Trots att FDA är en stark förespråkare för PED har det rapporterats att företag som ansöker om godkännande, liksom patienter och vårdgivare, inte får tillräcklig information om hur myndigheten använder sådana data i sina beslut när de granskar ansökningar om nya läkemedel eller biologiska produkter. På liknande sätt avslöjade en tvärvetenskaplig workshop under ledning av EMA att intressenter i industrin är av uppfattningen att EU:s tillsynsmyndighet inte välkomnar PED eller anser att informationen är värdefull.
De här faktorerna gör intressenter i industrin tveksamma till att ta med patientupplevelsedata i ansökningar om marknadsgodkännande. Senare har EMA förtydligat att de ”välkomnar och efterfrågar” PED som en del i ansökningar om marknadsgodkännande.
För att intressenter ska kunna ta fram relevanta, tillräckliga och tillförlitliga PED krävs ökad transparens kring användningen av sådan information i regulatoriska beslutsprocesser. För att uppnå denna transparens krävs ökad harmonisering mellan olika jurisdiktioner när det gäller regulatoriska krav på PED som samlas in under prövningar i flera regioner. Precis som European Federation of Pharmaceutical Industries and Associations (EFPIA) föreslog är ICH M4E en lämplig nivå för global harmonisering av dessa krav.

Bättre metod för insamling av data om patientrapporterade utfall
Även om regulatoriska oklarheter är viktiga för den övergripande utvecklingen av medicinsk utrustning är de förmodligen inte något akut orosmoln för prövningsdeltagare. En mer angelägen fråga är arbetsbördan som PRO-frågeformulär kan innebära för svarspersoner. Dessa faktorer kan bland annat bidra:
- Antalet PRO-frågeformulär i en prövning.
- Hur ofta PRO-bedömningar görs.
- Antalet frågor i PRO-frågeformulär/hur lång tid det tar att besvara dem.
- Upprepade eller likartade frågor i flera PRO-frågeformulär som används under prövningen.
- Otydligt språk.
- Opraktiskt format eller sätt att samla in PRO-data.
Det är avgörande att kunna förutse och minimera svarspersonernas arbetsbörda för att lyckas med en PRO-datainsamlingsstrategi under en prövning. Aiyegbusi med flera presenterade en kort sammanfattning av viktiga metodologiska aspekter som kan bidra till att minska bördan för svarspersoner. Det gäller exempelvis:
- Tydliga argument för valet av PRO:er som ska användas i en prövning.
- Ta hänsyn till åkommans natur och effekter av prövningsinsatser vid planering av bedömningar.
- Göra det enklare att genomföra PRO:er med hjälp av teknik, där så är lämpligt.
- Tidigt involvera och engagera patienter i beslut kring valet av och leverans av PRO:er.

Så kan språktjänstleverantörer bidra till bättre insamling av data om patientrapporterade utfall
Det stora antalet multinationella kliniska prövningar och ökad användning av ePRO-teknik har inneburit att prövningssponsorer ofta behöver ändra i ursprungliga PRO:er. Det kan handla om ändringar som översättning och kulturell anpassning till andra språk (lingvistisk validering) eller migrering av administreringssätt från pappersformat till ett elektroniskt format (ePRO-migrering). Genom att testa ändrade versioner på patientmålgrupper kan man enklare upptäcka och lösa problem innan versionerna används i en prövning. Det ger en rad fördelar:
- Patienter får möjlighet att vara delaktiga och engagerade i klinisk forskning och beslut om PRO:er.
- Bidrar till att robusta och tillförlitliga PRO-data samlas in under prövningen genom att PRO-bedömningar ”finjusteras” med hjälp av synpunkter från patienter.
- Minskar arbetsbördan för prövningsdeltagare
- Uppfyller evidensbaserade förväntningar från tillsynsmyndigheter beträffande processen för att ändra i PRO:er för målgrupper som ska använda dem under prövningen. Detta är särskilt relevant när PRO-data ska användas för att understödja marknadsföringsbudskap i produktmärkning.
Specialiserade språktjänstleverantörer (LSP) kan underlätta sådana tester genom kognitiv debriefing och procedurer för användbarhetstestning. Testning genomförs i ett eller flera relevanta målländer med en liten grupp som har målspråket/målspråken som modersmål och är representativa för målgruppen i den kliniska prövningen.
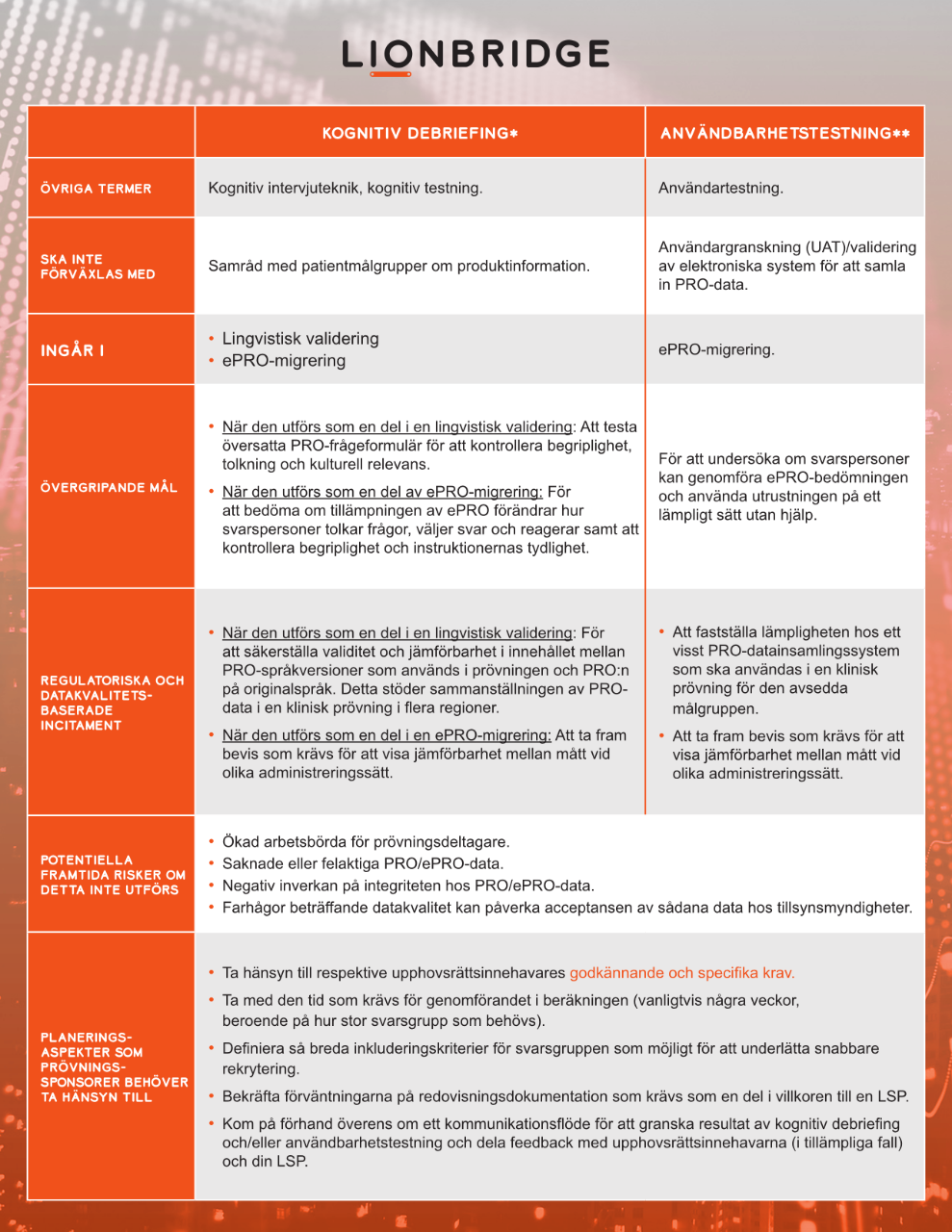
Blogginlägg: Tillstånd att använda bedömningar av kliniska utfall i kliniska prövningar
* med referens till ISPOR Task Force for Translation and Cultural Adaptation och Patient-Reported Outcome (PRO) Consortium
** med referens till ISPOR ePRO Good Research Practices Task Force och ISPOR Measurement Comparability Between Modes of Administration of PROMs Task Force
Kontakta oss
Behöver du språkhjälp för att samla in data om patientrapporterade utfall i kliniska prövningar? Lionbridge har djupgående kunskap om bedömning av kliniska utfall och är experter på översättningstjänster för Life Sciences. Kontakta oss i dag för att få veta mer om Lionbridge som språktjänstleverantör inom Life Sciences.




