- VAD VI GÖR
Ytterligare tjänster

- Branscher

Fallstudie: Flerspråkiga kampanjer i detaljhandeln
Nya AI-baserade lösningar för skapande av innehåll hos stort sport- och klädföretag

- RESURSER

- OM OSS

Startsida: Vad vi gör
Generativ AI
– AI-översättningstjänster
– Content Remix
AI-träning
– Aurora AI Studio™
Maskinöversättning
– Lionbridges bedömningsverktyg för MT
Smart onboarding
Tjänstemodeller för översättning
Innehållstjänster
– Teknisk dokumentation
– eLearning och utbildning
– Finansiella rapporter
– Digital marknadsföring
– SEO och innehållsoptimering
Översättningstjänster
– Videolokalisering
– Lokalisering av programvara
– Lokalisering av webbplatser
– Översättning för reglerade företag
– Tolkning
– Liveevenemang
– Language Quality Services
Testningstjänster
– Funktionstestning av spel
– Kompatibilitetstestning
– Interoperabilitetstestning
– Prestandatestning
– Tillgänglighetstestning
– Testning av användargränssnitt och kundupplevelse
Startsida: Branscher
Översättning för Life Sciences
– Översättning för läkemedelsindustrin
– Översättning för kliniska prövningar
– Regulatoriska översättningar
– Översättning efter godkännande
– Översättning för läkemedelsindustrin
– Språktjänster för medicintekniska produkter
– Validering och kliniska undersökningar
– Regulatoriska översättningar
– Översättning efter godkännande
– Översättning för tillverkare av medicintekniska produkter
Bank och finans
Detaljhandel
Lyxprodukter
E-handel
Lionbridge Games
Fordonsindustri
Konsumentförpackade varor
Teknik
Tillverkningsindustri
Juridiska tjänster
Resor, hotell och restaurang
Insikter
– Blogginlägg
– Fallstudier
– Faktablad
– Lösningsöversikter
– Infografik
– e-böcker
– Videor
Webbinarier
Lionbridges kunskapscenter
– Positiva patientutfall
– Moderna lösningar för kliniska prövningar
– Patientengagemang
- Tankeledarskap inom AI
VÄLJ SPRÅK:
År 2017 publicerades två nya EU-förordningar i EUR-Lex som ställde världen på ända för tillverkare av medicinteknisk utrustning som ville sälja sina produkter på den europeiska marknaden. MDR och IVDR ersätter äldre direktiv om medicinteknisk utrustning som har funnits sedan 1990-talet. I och med ikraftträdandedatumet för IVDR den 26 maj 2022 är nu övergångsperioden avslutad för båda dessa nya förordningar. De nya förordningarna har nu helt trätt i kraft, även om det finns undantag för viss utrustning som får finnas kvar på marknaden under ytterligare en viss ”uppskovsperiod”.
Den 26 maj 2022 är också årsdagen för ikraftträdandet av MDR. Det senaste året har vi på Lionbridge samarbetat med våra kunder inom medicinsk teknik för att hitta lämpliga och flexibla lösningar på de språkliga utmaningar som uppstår till följd av de regulatoriska kraven i de nya reformerna. Resan har bara börjat och vi vill göra vårt bästa för att hjälpa kunder att centralisera översättningar och använda språkliga tillgångar under utrustningens hela livscykel.

Enligt båda förordningarna krävs kontroll över tillverkarnas produktportfölj under utrustningens hela livscykel, liksom offentlig publicering av utrustningens prestanda och säkerhet via EUDAMED-databasen. Det har aldrig funnits ett bättre tillfälle för tillverkare av medicinsk teknik att se över språkstrategin för hela sin portfölj av medicinteknisk utrustning.
MDR och IVDR leder till likartade innehållskrav och språkliga utmaningar för tillverkare. Arbetsbördan lär öka på grund av de nya dokumentationskraven under livscykeln för båda typer av utrustning, samt nya krav på transparens för medicinteknik som används på den europeiska marknaden.
Lionbridge har tidigare presenterat vår syn på saken och våra rekommendationer om hur tillverkare kan hantera språkbarriärer med vår MDR-serie. Vi har nu utvecklat våra insikter till att även omfatta IVDR genom publiceringen av vårt nya faktablad om IVDR.

Ett råd som vi fortsätter att ge är att tillverkare bör planera översättningar och språktillgångar samtidigt som de utvecklar andra delar av utrustningen och även skapa kontrollprocesser.
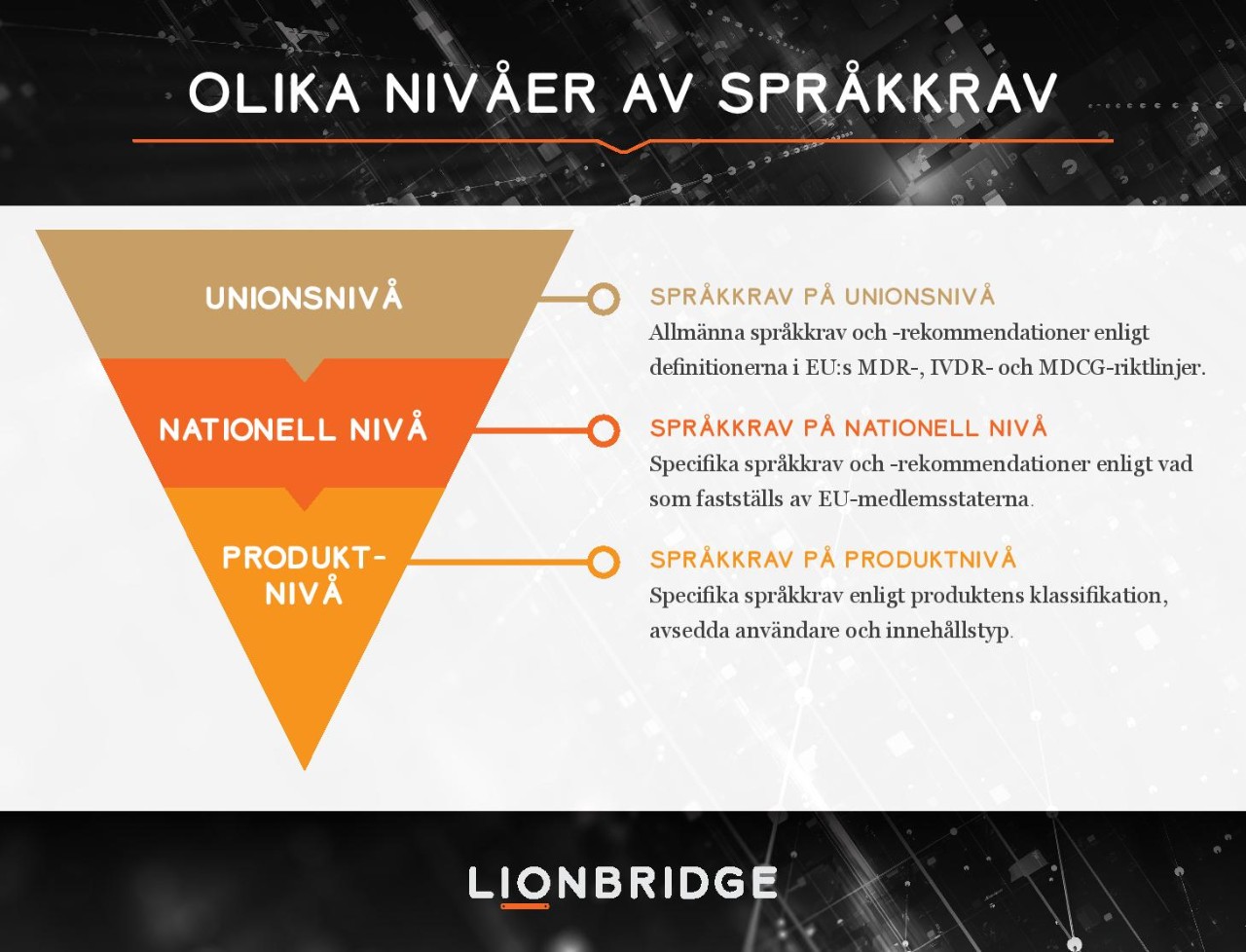
EU är en flerspråkig region. Även om harmoniseringen är ett tydligt incitament för att uppgradera gamla EU-direktiv till förordningar, förblir språket en nationell fråga som avgörs av respektive nationell behörig myndighet. Vi uppmuntrar tillverkare att betrakta språk som en process i flera lager för att enklare kunna styra och optimera språkaktiviteter för hela utrustningsportföljen.