- 我们的服务范围

- 行业

- 资源

- 公司简介

选择语言:
明确欧盟的监管类文件翻译需求
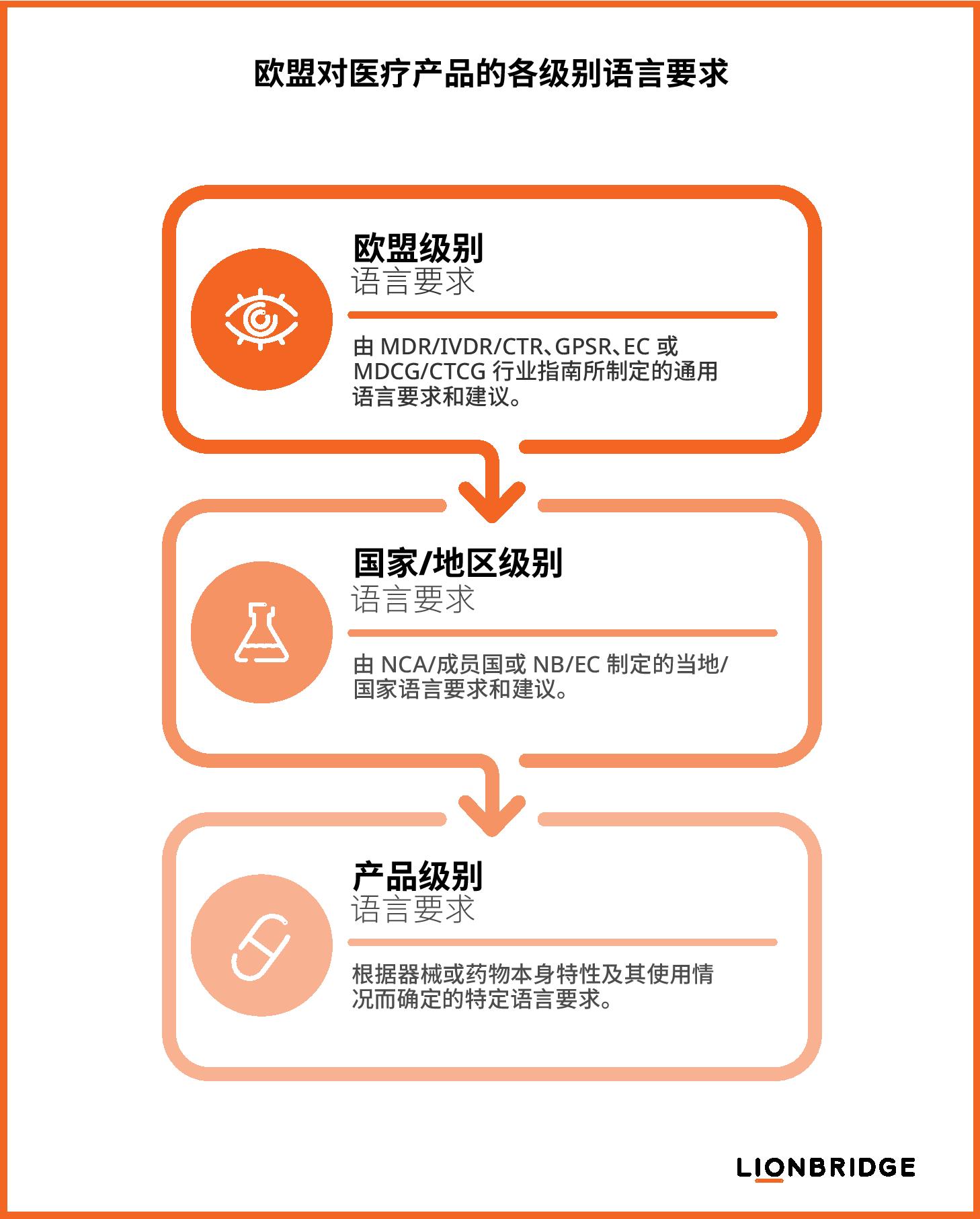
根据欧盟医疗器械和临床试验法规,制造商或临床试验申办者应考虑以下三个级别的语言要求,以确保符合生命科学方面的法律法规:
欧盟级要求:列于《医疗器械法规》(MDR)/《体外诊断医疗器械法规》(IVDR)/《临床试验法规》(CTR)、《通用产品安全法规》(GPSR)、欧盟委员会 (EC) 公告,以及医疗器械协调小组 (MDCG) 或临床试验协调小组 (CTCG) 发布的行业指导性文件
国家级要求:由各成员国的国家主管当局 (NCA) 制定,其中一部分要求由公告机构 (NB) 在医疗器械合格评定程序中执行,或由伦理委员会 (EC) 在临床试验授权程序中执行。
产品级要求:根据具体产品的注意事项决定,例如使用情况、产品特性或预期用户/目的。
要符合生命科学类的法律法规,需满足欧盟级别的语言要求
欧盟级别的语言要求涉及范围较广。基本上,所有进入欧盟市场的消费品均须遵守 GPSR。GPSR 要求以产品供应地成员国所确定的官方语言提供以下信息:
- 用户说明
- 标签信息
- 消费品的文档
对于需要满足额外安全和性能要求的产品(例如医疗器械和药品),语言要求不仅限于产品随附的标签和信息。例如,如果为确保设备的安全和性能,制造商应负责使用简洁直白语言或当地语言提供支持,则此类支持信息也应符合上述语言要求。欧盟级别语言要求并不决定各成员国所需的具体国家语言。
国家级别语言要求
NCA 决定其各自市场中每种器械或药品信息需使用具体哪种国家语言。一般来说,所有针对患者的内容都必须以各成员国的当地语言提供,以确保患者安全。然而,成员国主管当局也会考虑到沟通的其他方面,例如:
- 读者的文化水平
- 技术/医学知识
- 培训
欧盟各国的 NCA 对英语是否为常用语言以及面向专业用户的内容是否可以用英语持有不同意见。在某些成员国,例如法国、意大利以及较多东欧成员国(包括保加利亚、匈牙利和立陶宛),以下内容必须使用当地语言:
- 市场营销
- 现场安全通知
- 认证
在其他一些国家,例如北欧成员国丹麦和瑞典,英语则可以接受。
产品级别语言要求
产品级要求涵盖某些器械或药物的特殊使用情况,例如用于自我检测或近患检测的体外诊断医疗器械或用于采集患者数据的移动应用程序。
如果欧盟或国家级别没有出台相关规定,那么制造商应根据器械或药物的具体使用情况来决定语言需求。如有疑问,我们的全球合规解决方案专家建议在将器械或药品投放市场或投入临床研究之前先咨询 NB 或 NCA。
只有沟通无阻,才能确保使用无碍以及安全性和透明度
制造商和临床试验申办者必须确保符合生命科学法规中的语言要求,才能进入欧盟市场。然而,语言要求不仅仅是形式上的走过场。只有以欧盟当地语言提供信息,才能确保所有产品用户或试用志愿者都能轻松获取、阅读并了解信息。此外,高质量的翻译和顾及文化差异有助于制造商扩大市场影响力并确保其产品的安全使用。
联系我们
您在进军多语言的欧盟市场时是否因语言相关规定而倍感挑战?与 Lionbridge 合作,获得欧盟合规解决方案。我们在欧盟语言和欧盟医疗器械和药品法规方面拥有数十年的经验。我们的合规解决方案包括生命科学翻译和语言服务,可在所有产品阶段提供支持。
请填写联系表与我们联系。
我们渴望倾听您的需求,并向您展示我们的创新功能如何助您冲破藩篱、拓宽全球舞台。期待探索新机遇?我们随时待命,愿助您扬帆启航。