- 服務內容

- 產業

- 資源

服務內容首頁
生成式 AI
- AI 翻譯服務
- Content Remix
AI 訓練
- Aurora AI Studio™
機器翻譯
- MT 追蹤工具
Smart Onboarding
翻譯服務模式
內容服務
- 技術文件編寫
- 訓練與線上學習
- 財務報告
- 數位行銷
- SEO 與內容最佳化
翻譯服務
- 影音內容本地化
- 軟體本地化
- 網站本地化
- 受監管公司適用的翻譯服務
- 口譯
- 現場活動
- Lionbridge Language Quality Services
測試服務
- 功能品管與測試
- 相容性測試
- 互操作性測試
- 效能測試
- 輔助使用性測試
- 使用者體驗 / 客戶體驗測試
選擇語言:
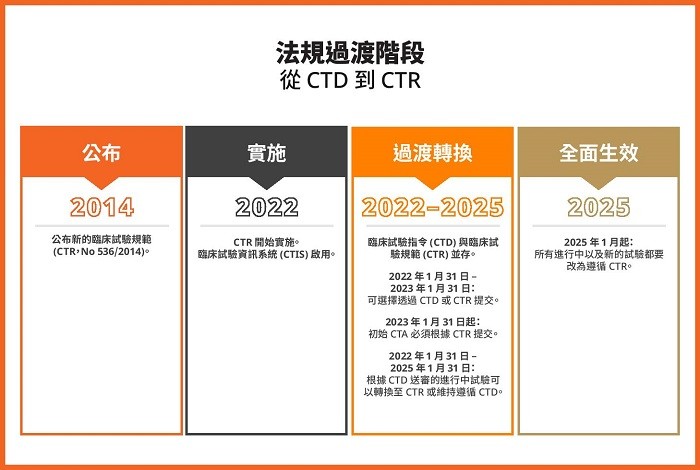
歐盟在 2014 年公布了臨床試驗規範 (Clinical Trials Regulation,CTR),也徹底改變了歐洲臨床試驗的法規環境。舊有法規,也就是臨床試驗指令 (Clinical Trials Directive,CTD),已於 2022 年 1 月 31 日廢除,而新舊法規間為期三年的過渡期,也將於 2024 年結束。CTR 預計將於 2025 年 1 月 31 日全面生效。進行中試驗的最後受試者訪視 (Last Patient Visit) 若是落在 2025 年 1 月 30 日之後,必須要由 EudraCT 轉換至臨床試驗資訊系統 (Clinical Trials Information System,CTIS)。完成轉換後,試驗委託者將會發現,有鑑於臨床試驗的規模越來越大、內容越來越多,臨床試驗的語言策略對於遵循 CTR 也會變得更加重要。歡迎繼續閱讀,了解 CTR 可能有哪些語言挑戰,以及 AI 如何有助因應這些挑戰。
從動盪不安到卓越非凡
CTR 的實施,旨在促進歐盟境內的多國臨床研究。儘管一路走來難免遇到一些動盪不安和負擔,當局仍舊堅持要推動這個改革,以期能調和整個歐盟對臨床試驗的要求並最佳化其執行。隨著臨床試驗資訊系統 (CTIS) 的實施,整個歐盟的臨床試驗申請程序也將更加有效率,日後可能只需送件一次,即可由所有相關成員國聯合進行評估。這個新程序可以將標準時程由 60 天縮短至 45 天,但資訊補件要求的延長時間不算在內。
另外,歐盟也針對從舊有指令轉換至新規範訂定了法定過渡期,讓各成員國有足夠的時間協調與統合技術方面的要求,這種作法可望提高臨床試驗核准與執行的效率,對委託者、病人及監管機關都有好處。病人跟可能的試驗參加者也將可透過 CTIS 的公共介面,取得區域性臨床試驗的相關資訊,進而提高區域性臨床研究的公開透明度。
根據歐洲藥品管理局的說明,制訂 CTR 的用意,是要:
「...增進歐盟境內的創新與研究,促進在多個歐盟成員國/EEA 國家中進行規模更大的臨床試驗。」
根據歐洲藥品管理局的說明,CTIS 的好處包括:
- 「讓試驗委託者得以透過線上提交一次資料,即可向最多 30 個歐洲國家申請核准進行臨床試驗;
- 讓多個國家的監管機關可以協同合作,一同處理臨床試驗的申請、要求補充更多資訊、核准或駁回試驗,以及監督獲核准的試驗;
- 促進臨床試驗將規模擴展至其他 EEA 國家;
- 讓任何對在 EEA 內執行之臨床試驗感興趣的人士,得以透過可搜尋的公眾網站取得相關資訊,維護試驗的公開透明。」
多國試驗的規模為平均六個成員國
自 2022 年啟用 CTIS 以來,已有 3,657 個臨床試驗透過它送件。光是 2024 年 1 月,就有 309 件臨床試驗申請 (Clinical Trial Application,CTA),這其中有 170 件是初始 CTA,而多國試驗中則以商業贊助的臨床試驗為最大宗。到 2024 年 1 月為止,CTIS 中獲得核准的多國臨床試驗共有 1,144 個,而這些臨床試驗涵蓋的成員國數目平均為六個。由於歐盟成員國對於要以在地官方語言準備哪些內容各有規定,因此所有這些試驗的送審文件自然也都需要翻譯。自 2022 年 1 月後提交的多國試驗中,各國的初始 CTA 數目分布如下圖所示。

AI 解決方案:研擬採用 AI 技術的語言策略,因應對規模與速度的需求
如果 CTR 成功地吸引委託者在歐盟進行規模更大的臨床試驗,那麼語言不但會導致臨床試驗的預算增加,也會加重負責管理臨床試驗申請及在地審閱 (ICR) 人員的工作負擔。此外,在試驗的籌備階段,也必須審慎規劃語言方面的事務,確保所有語言都能做好以下準備:
- 透過 CTIS 同時送件
- 因應法規審閱緊湊時程的任何更新要求
這個系統採用默會決定原則,也就是說,如果委託者在成員國主管機關的資訊補件要求截止日期前沒有回覆的話,對所有相關成員國而言該申請就自動失效。
大型語言模型 (LLM) 與生命科學 AI 服務,或許能一方面大幅加快臨床試驗翻譯作業的速度,同時又能確保這些大量內容間的語言一致性。尤其值得注意的是,LLM 的輸出品質正迅速進步中。如果能將強有力的語言策略,與事先定義好人工干預程度的 LLM 相結合,試驗委託者就能獲益於 AI 解決方案 (同時仍舊能夠降低風險)。正如下圖所示,委託者可以針對更多不同的層級來設計這類策略。

與我們聯絡
需要協助您為生命科學翻譯研擬策略嗎?對生命科學適用的 AI 解決方案感興趣嗎?Lionbridge 在臨床試驗翻譯上擁有數十年的深厚知識及專業能力,歡迎立即與我們聯絡,深入了解 Lionbridge 做為生命科學語言服務供應商所提供的各項服務。




