- 服務內容

- 產業

- 資源

服務內容首頁
生成式 AI
- AI 翻譯服務
- Content Remix
AI 訓練
- Aurora AI Studio™
機器翻譯
- MT 追蹤工具
Smart Onboarding
翻譯服務模式
內容服務
- 技術文件編寫
- 訓練與線上學習
- 財務報告
- 數位行銷
- SEO 與內容最佳化
翻譯服務
- 影音內容本地化
- 軟體本地化
- 網站本地化
- 受監管公司適用的翻譯服務
- 口譯
- 現場活動
- Lionbridge Language Quality Services
測試服務
- 功能品管與測試
- 相容性測試
- 互操作性測試
- 效能測試
- 輔助使用性測試
- 使用者體驗 / 客戶體驗測試
選擇語言:
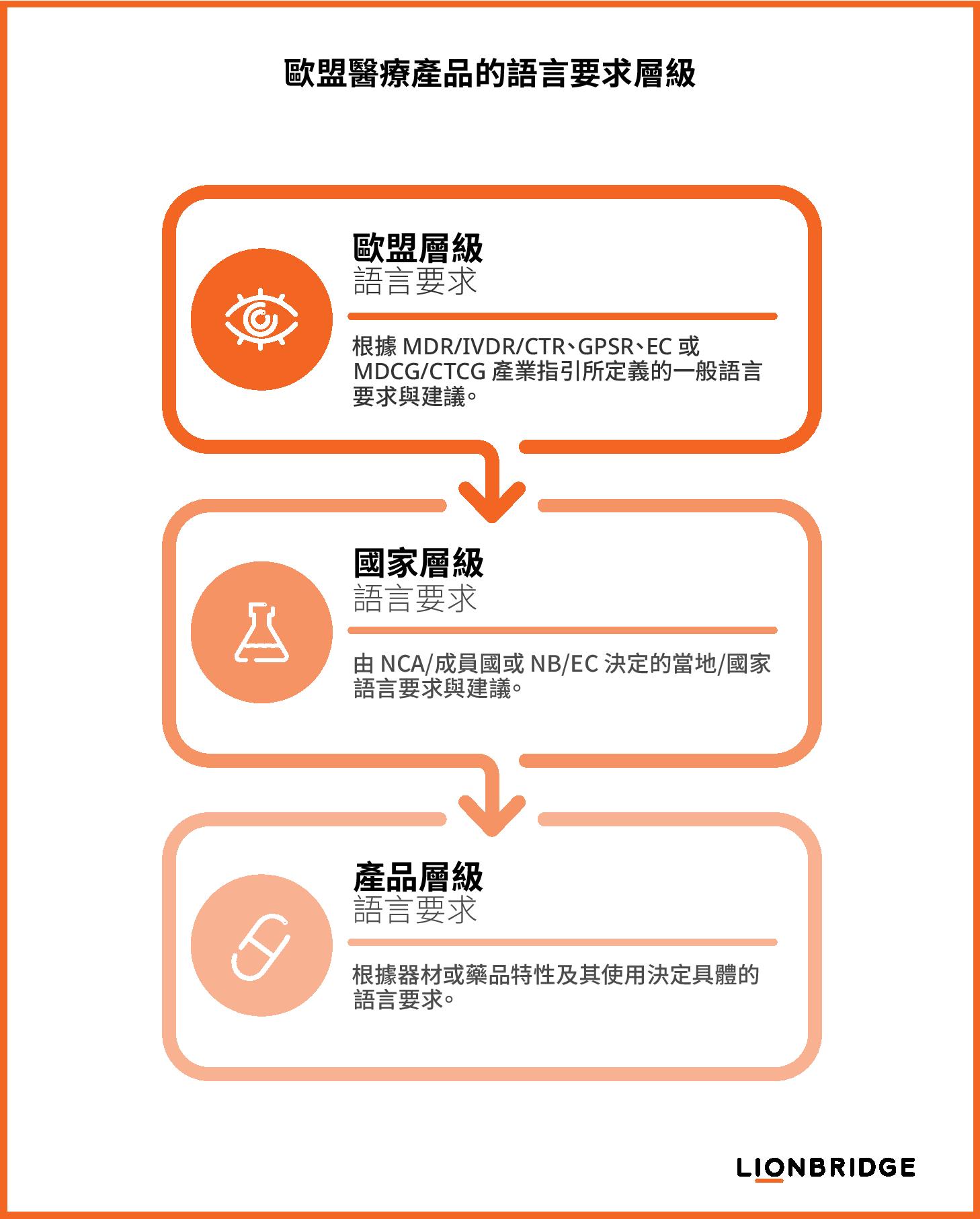
判斷歐盟內受規範翻譯的需求
根據歐盟醫療器材法規和臨床試驗規範,為了確保遵循生命科學相關法規,製造商或臨床試驗委託者必須妥善考量以下這三個語言要求層級:
歐盟層級的要求:係由 MDR/IVDR/CTR、一般產品安全法規 (GPSR)、歐盟執行委員會 (EC) 出版品,以及醫療器材協調小組 (MDCG) 或臨床試驗協調小組 (CTCG) 發佈的產業指引文件所規範。
國家層級的要求:由各成員國之國家權責機關 (NCA) 決定,執行部分是由代施查核機構 (NB) 應醫療器材之符合性評鑑程序或是倫理委員會 (EC) 應臨床試驗授權程序進行。
產品層級的要求:根據特定的產品考量而定,例如使用情境、產品特性、目標對象或用途。
生命科學法規遵循:歐盟層級的語言要求
歐盟層級的語言要求適用於一般情況。基本上,所有歐盟內的消費性產品都受一般產品安全法規 (GPSR) 所約束。根據 GPSR 的規定,廠商必須以產品販售所在之成員國規定的官方語言,提供以下項目:
- 使用說明
- 標示資訊
- 消費性產品的文件
如果產品還受其他安全性和成效要求所約束,例如醫療器材和藥品等,語言要求的範疇就不僅只有產品隨附的標示和資訊。例如,若製造商必須負責確保以簡潔淺白或在地的語言支持器材的安全性和成效時,這些資訊也得要符合這些語言要求。不過,歐盟層級的語言要求並未規定個別成員國會所要求使用的具體國家語言為何。
國家層級的語言要求
器材或藥品的每種資訊類型在各國市場中必須以哪些國家語言提供,是由相應的國家權責機關 (NCA) 所決定。一般而言,為了確保病人安全,所有供病人參考的內容,都必須以各個成員國的在地語言提供。然而,成員國權責機關也可以將溝通的其他層面納入考量,例如:
- 讀者的識讀程度
- 技術/醫療知識
- 訓練
對於是否將英文視為普遍可理解的語言,以及是否接受以英文撰寫供專業人士閱讀的內容,歐盟內各 NCA 的規定不盡相同。有些成員國,例如法國、義大利以及包括保加利亞、匈牙利和立陶宛等許多東歐成員國,要求必須以在地語言提供下列內容:
- 行銷
- 市場安全通知
- 認證
至於其他一些國家,例如北歐成員國丹麥和瑞典,則是以豁免的方式接受使用英文。
產品層級的語言要求
產品層級的語言要求包含了特定器材或藥品的獨特使用案例,例如供自我檢測或病人端檢測的體外診斷醫療器材,或是用以擷取病人資料的行動應用程式等。
製造商應該根據器材或藥品的具體使用情境來決定語言需求,因為歐盟或國家層級出版的指引文件有時可能並不足以因應實際的情況。我們的全球法規解決方案專家建議,如有疑慮,應先諮詢代施查核機構或國家權責機關,解決後再於市場或臨床研究中推出器材或藥品。
語言能增進取用性、安全性和透明度
想要進入歐盟市場的製造商和臨床試驗委託者,必須確保遵循生命科學相關法規對語言的要求。但是,語言考量並不只是虛應法規的例行公事。以歐盟在地語言提供資訊非常重要,唯有如此,所有產品使用者或試驗志願參加者才能簡便地取得通順易讀的資訊,達成公開透明的目標。此外,提供高品質的翻譯並妥善處理文化間的細微差異,也有助於製造商拓展市場能見度,並確保使用者能安全地使用其產品。
與我們聯絡
在多語言的歐盟市場中遇到受規範語言內容方面的困難嗎?歡迎與 Lionbridge 合作,採用我們為歐盟打造的法規解決方案。我們在醫療器材和藥品的歐盟語言及歐盟法規上,擁有數十年的豐富經驗,能運用我們的生命科學翻譯及語言服務,打造可支援所有產品階段的法規解決方案。
歡迎填寫聯絡表單,與我們聯絡展開討論。
充滿熱忱的我們很希望了解您的需求,並與您分享我們的創新作法如何能賦予您更多能力,進而暢行無阻地拓展全球觸及範疇。準備好探索更多可能性嗎?歡迎給我們機會協助您達成目標。