- QUÉ HACEMOS
Soluciones de IA
Servicios Adicionales

Seminario web
Creación de un caso de rendimiento estratégico para la entrada a mercados locales

- Sectores
Traducción para el sector biomédico
Traducción para el sector farmacéutico
Traducción de ensayos clínicos
Traducción de documentos normativos
Traducción posterior a la aprobación
Servicios corporativos de traducciones farmacéuticas
Servicios lingüísticos de productos sanitarios
Validación e investigación clínica
Traducción de documentos normativos

Caso práctico: marketing multilingüe para minoristas
Nuevas soluciones de creación de contenido con IA para un gigante especializado en prendas y artículos deportivos

- RECURSOS
Centros de conocimiento de Lionbridge
Resultados positivos para los pacientes

- QUIÉNES SOMOS

Talento en acción: Lex Parisi
Director de Soluciones de Marketing de Juegos de Lionbridge Games

Inicio de Qué hacemos
IA generativa
- Traducción con IA
- Content Remix
Entrenamiento de la IA
- Aurora AI Studio™
Traducción automática
- MT Tracker
Smart Onboarding
Modelos de servicios de traducción
Servicios de contenido
- Redacción técnica
- Formación y aprendizaje electrónico
- Informes financieros
- Marketing digital
- SEO y optimización de contenido
Servicios de traducción
- Localización de vídeo
- Localización de software
- Localización de sitios web
- Traducción para empresas reguladas
- Interpretación
- Eventos en directo
- Servicios de calidad lingüística
Servicios de testing
- Testing y control de calidad funcional
- Pruebas de compatibilidad
- Pruebas de interoperabilidad
- Pruebas de rendimiento
- Pruebas de accesibilidad
- Pruebas de experiencia de usuario/cliente
Inicio de Sectores
Traducción para el sector biomédico
- Traducción para el sector farmacéutico
- Traducción de ensayos clínicos
- Traducción de documentos normativos
- Traducción posterior a la aprobación
- Servicios corporativos de traducciones farmacéuticas
- Servicios lingüísticos de productos sanitarios
- Validación e investigación clínica
- Traducción de documentos normativos
- Traducción tras la autorización
- Traducción corporativa de productos sanitarios
Banca y finanzas
Comercio minorista
Productos de lujo
Comercio electrónico
Lionbridge Games
Automoción
Productos de consumo envasados
Tecnología
Fabricación industrial
Servicios jurídicos
Turismo y hostelería
Novedades
- Entradas de blog
- Casos prácticos
- Artículos
- Resúmenes de productos
- Infografías
- Libros electrónicos
- Vídeos
Seminarios web
Centros de conocimiento de Lionbridge
- Resultados positivos para los pacientes
- Soluciones para los ensayos clínicos modernos
- Compromiso del paciente
- Liderazgo intelectual en la IA
SELECCIONAR IDIOMA:
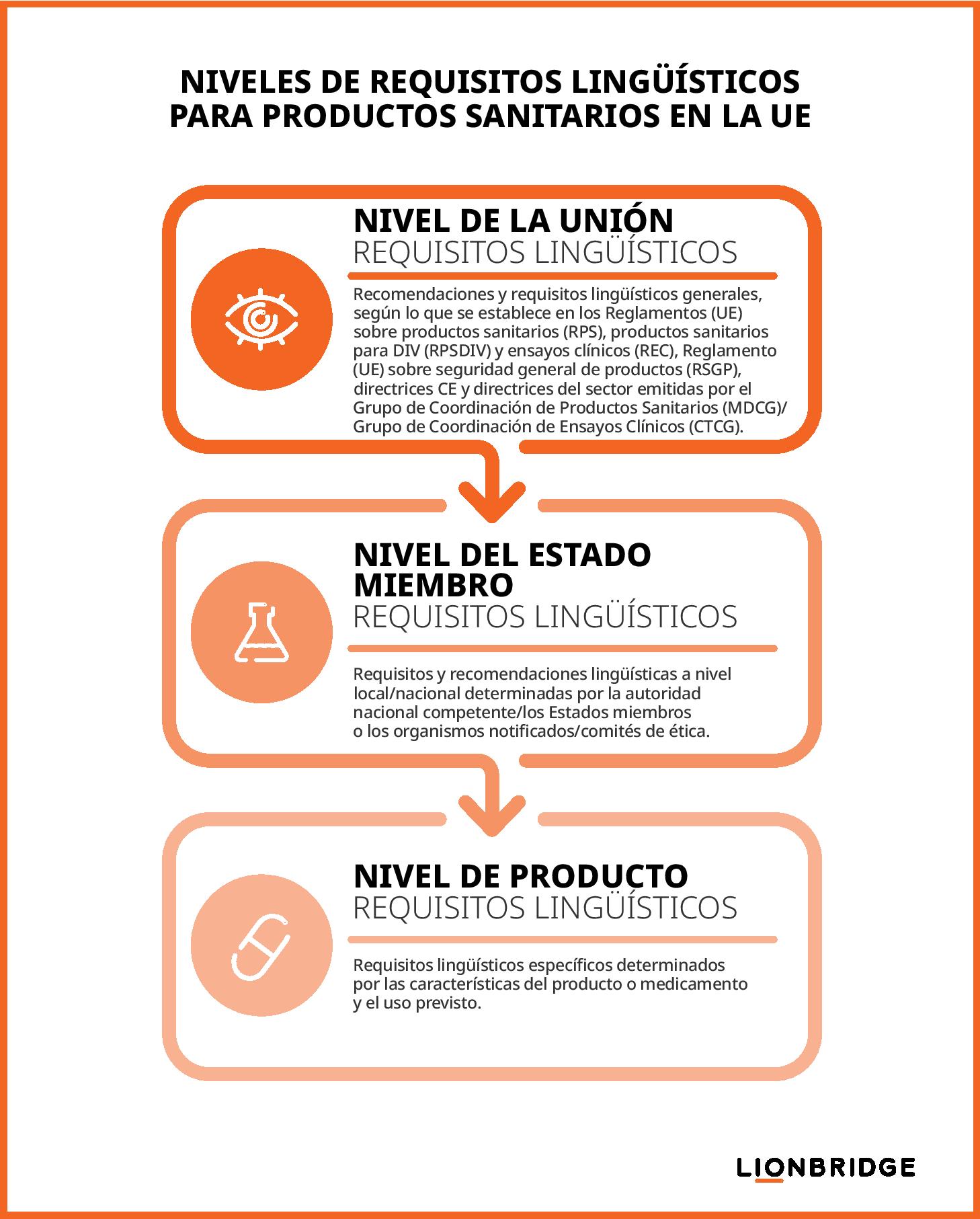
En una entrada anterior de nuestro blog, nos ocupamos del mercado multilingüe de la UE y analizamos cómo la política multilingüe de la Unión repercute en el cumplimiento normativo del sector biomédico en relación con los requisitos lingüísticos para traducciones normativas. Este blog profundizará en los tres niveles de requisitos lingüísticos que estos grupos deben conocer:
- Fabricante del dispositivo
- Operador económico
- Promotor de ensayos para productos médicos en la UE
Determinación de las necesidades de traducción reglamentaria en la UE
De acuerdo con el Reglamento sobre dispositivos médicos y el Reglamento sobre ensayos clínicos de la UE, los fabricantes o promotores de ensayos clínicos deben tener en cuenta estos tres niveles de requisitos lingüísticos para garantizar el cumplimiento normativo en el sector biomédico.
Requisitos de la Unión: definidos en los Reglamentos (UE) RPS, RPSDIV y REC, el Reglamento (UE) sobre seguridad general de productos (RSGP), las publicaciones de la Comisión Europea (CE) y los documentos de directrices de la industria publicados por el Grupo de Coordinación de Productos Sanitarios (MDCG) o el Grupo de Coordinación de Ensayos Clínicos (CTCG)
Requisitos nacionales: determinados por las autoridades competentes nacionales (ANC) de cada Estado miembro y parcialmente aplicados por los organismos notificados (NB) como parte de los procedimientos de evaluación de la conformidad de los dispositivos médicos o por los comités de ética (CE), dentro de los procedimientos de autorización de ensayos clínicos.
Requisitos de producto: determinados por consideraciones específicas del producto, como el contexto de uso, las características del producto o los usuarios o propósitos previstos.
Requisitos lingüísticos de la Unión para el cumplimiento normativo en el sector biomédico
Los requisitos lingüísticos de la Unión son de carácter general. Básicamente, todos los productos de consumo comercializados en la UE deben cumplir con lo establecido en el Reglamento (UE) sobre seguridad general de productos (RSGP). El RSGP exige que estos elementos se proporcionen en los idiomas oficiales que determinen los Estados miembros donde se comercializan los productos:
- Instrucciones de uso
- Información de etiquetado
- Documentación para productos de consumo
En el caso de productos sujetos a requisitos adicionales de seguridad y rendimiento, como dispositivos médicos y medicamentos, los requisitos de idioma se extienden más allá de la etiqueta y la información suministrada con el producto. Se aplican, por ejemplo, cuando el fabricante es responsable de garantizar un lenguaje conciso, claro o localizado para respaldar la seguridad y el rendimiento de los dispositivos. Los requisitos lingüísticos de la Unión no determinan qué lenguas nacionales específicas se requieren en cada Estado miembro.
Requisitos lingüísticos de los Estados miembros
Las Autoridades Nacionales Competentes (ANC) determinan qué idiomas nacionales específicos se requieren para cada tipo de información sobre dispositivos o medicamentos en sus respectivos mercados. En términos generales, todo el contenido destinado a los pacientes debe estar disponible en los idiomas locales de cada uno de los Estados miembros para garantizar la seguridad de los pacientes. Sin embargo, las autoridades de los Estados miembros también tienen en cuenta otros aspectos de la comunicación, como:
- Niveles de alfabetización de los lectores
- Conocimientos técnicos/médicos
- Formación
Las autoridades nacionales competentes (ANC) de la UE difieren en cuanto a si el inglés se considera un idioma comúnmente entendido y si el contenido destinado a usuarios profesionales se puede proporcionar en ese idioma. En algunos Estados miembros, como Francia, Italia y otros Estados miembros de Europa del Este, como Bulgaria, Hungría y Lituania, este contenido debe estar en el idioma local:
- Marketing
- Notificaciones de seguridad de campo
- Certificación
El inglés se acepta como excepción en algunos otros países, como los estados miembros del norte de Europa Dinamarca y Suecia.
Requisitos lingüísticos de los productos
Los requisitos de producto incluyen casos de uso únicos para ciertos dispositivos o medicamentos, por ejemplo, un dispositivo de diagnóstico in vitro destinado a pruebas de autodiagnóstico o pruebas cercanas al paciente, o una aplicación móvil para capturar datos del paciente.
Los fabricantes deben considerar el contexto específico del uso del dispositivo o medicamento para determinar las necesidades lingüísticas en los casos en que las publicaciones de la Unión o nacionales no lo aborden de manera suficiente. En caso de duda, nuestros expertos en soluciones regulatorias globales recomiendan consultar al Organismo Notificado o las Autoridades Nacionales Competentes antes de lanzar un dispositivo o medicamento al mercado o de usarlo en estudios clínicos.
El lenguaje impulsa el acceso, la seguridad y la transparencia
Para entrar en el mercado de la UE, los fabricantes y promotores de ensayos clínicos deben garantizar el cumplimiento de los requisitos normativos en el sector biomédico en lo que respecta a los requisitos lingüísticos. Sin embargo, las consideraciones lingüísticas son más que un ejercicio de marcar casillas. Poner la información a disposición en los idiomas locales de la UE es fundamental para que sea accesible, legible y transparente para todos los usuarios de productos o voluntarios de ensayos. Además, unas traducciones de gran calidad y la inclusión de matices culturales ayudan a los fabricantes a ampliar su presencia en el mercado y a garantizar que sus productos se utilicen de forma segura.
Póngase en contacto con nosotros
¿Quiere resolver los desafíos que plantean los resultados lingüísticos regulados en la UE multilingüe? Asóciese con Lionbridge para obtener soluciones regulatorias en la UE. Contamos con décadas de experiencia con los idiomas de la UE y los Reglamentos de la UE para dispositivos médicos y medicamentos. Nuestras soluciones normativas respaldan todas las etapas del producto con nuestros servicios de traducción y lingüísticos para el sector biomédico.
Rellene nuestro formulario de contacto para hablar con nosotros.
Nos encantará conocer sus necesidades e informarle acerca de cómo pueden ayudarle nuestras innovadoras funciones a traspasar fronteras y ampliar su alcance global. ¿Quiere descubrir nuevas posibilidades? Estamos deseando mostrárselas.