- CE QUE NOUS FAISONS
Services Supplémentaires

Webinaire
Élaboration d’un cas de revenus stratégique pour l’entrée sur le marché local

- Secteurs

Étude de cas
Nouvelles solutions de création de contenu par l'IA pour un géant des accessoires et vêtements de sport

- RESSOURCES
Pôles de connaissances Lionbridge
Résultats positifs pour les patients

- NOTRE ENTREPRISE

Accueil Notre offre
IA générative
- Services de traduction avec l'IA
- Réutilisation de contenu
Entraînement de l'IA
- Aurora AI Studio™
Traduction automatique
- MT Tracker
Intégration intelligente
Modèles de services de traduction
Services de contenu
- Rédaction technique
- Formations et eLearning
- Rapports financiers
- Marketing numérique
- Référencement naturel (SEO) et optimisation de contenu
Services de traduction
- Localisation de vidéos
- Localisation de logiciels
- Localisation de sites Web
- Traduction pour les entreprises réglementées
- Interprétation
- Événements en direct
- Services de qualité linguistique
Services de tests
- Assurance qualité et tests fonctionnels
- Tests de compatibilité
- Tests d'interopérabilité
- Test des performances
- Tests d'accessibilité
- Essai Expérience utilisateur/Expérience client
Accueil Secteurs
Traduction sciences de la vie
- Traduction pharmaceutique
- Traduction essais cliniques
- Traduction réglementaire
- Traduction post-approbation
- Traduction pharma entreprise
- Services linguistiques dispositifs médicaux
- Validation et cliniques
- Traduction réglementaire
- Traduction post-autorisation
- Traduction dispositifs médicaux entreprise
Banque et finance
Vente au détail
Luxe
E-commerce
Lionbridge Games
Automobile
Produits de grande consommation
Technologie
Fabrication industrielle
Services juridiques
Voyage et tourisme
Perspectives
- Articles de blog
- Études de cas
- Livres blancs
- Fiches de solutions
- Infographies
- eBooks
- Vidéos
Webinaires
Pôles de connaissances Lionbridge
- Résultats positifs pour les patients
- Solutions modernes pour essais cliniques
- Engagement des patients
- Leadership éclairé sur l'IA
SÉLECTIONNER LA LANGUE :
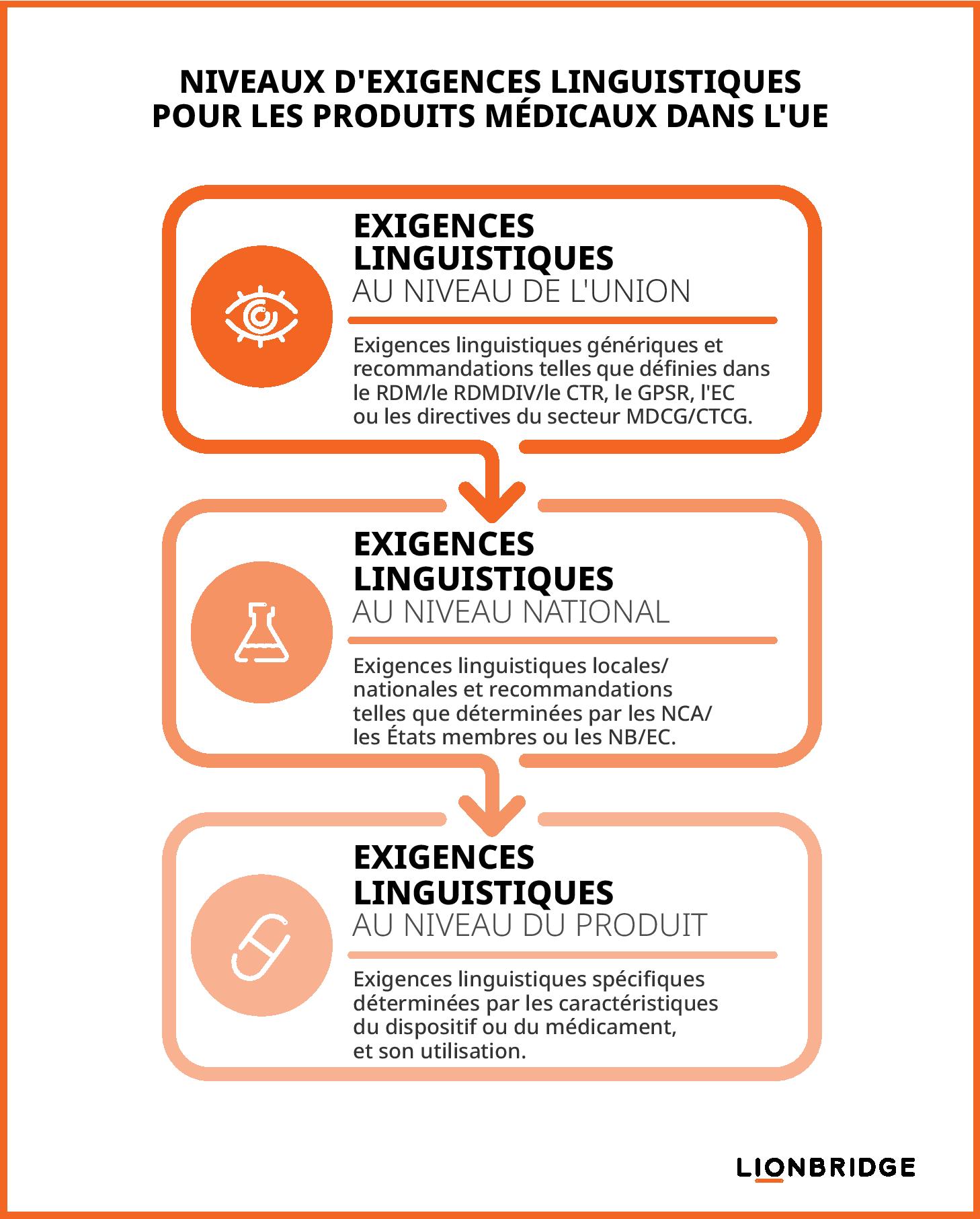
Dans un précédent article de blog, nous avons abordé le marché multilingue de l'UE et l'impact de la politique multilingue de l'Union sur la conformité réglementaire, dans le secteur des sciences de la vie, concernant les exigences linguistiques pour les traductions réglementaires. Cet article de blog examine plus en détail les trois niveaux d’exigences linguistiques que ces groupes doivent connaître :
- Fabricant d'appareils
- Opérateur économique
- Promoteur d'essai pour les produits médicaux de l'UE
Déterminer les besoins en traduction réglementaire dans l'UE
Conformément aux réglementations de l’UE relatives aux dispositifs médicaux et aux essais cliniques, un fabricant ou un promoteur d’essai clinique doit prendre en compte ces trois niveaux d’exigences linguistiques pour garantir la conformité réglementaire en sciences de la vie :
Exigences au niveau de l'Union : définies dans le RDM/RDMDIV/RCE, le règlement sur la sécurité générale des produits (RSGP), les publications de la Commission européenne (CE) et les documents de directives du secteur publiés par le Groupe de coordination en matière de dispositifs médicaux (GCDM) ou le Groupe de coordination des essais cliniques (CTCG)
Exigences au niveau national : déterminées par les autorités nationales compétentes (ANC) de chaque État membre et appliquées en partie par les organismes notifiés (ON) dans le cadre des procédures d'évaluation de la conformité des dispositifs médicaux ou par les comités d'éthique (CE) dans le cadre des procédures d'autorisation des essais cliniques.
Exigences au niveau du produit : déterminées par des considérations spécifiques au produit, telles que le contexte d'utilisation, les caractéristiques ou les utilisateurs ou objectifs prévus.
Exigences linguistiques au niveau de l'Union pour la conformité réglementaire en sciences de la vie
Les exigences linguistiques au niveau de l'Union sont générales. Tous les produits de consommation commercialisés dans l’UE sont soumis au Règlement sur la sécurité générale des produits (RSGP). Le RGSP exige que ces produits soient fournis dans les langues officielles déterminées par les États membres où les produits sont mis à disposition :
- Instructions d'utilisation
- Informations d'étiquetage
- Documentation des produits de consommation
Pour les produits soumis à des exigences supplémentaires en matière de sécurité et de performance, tels que les dispositifs médicaux et les médicaments, les exigences linguistiques s’étendent au-delà de l’étiquette et des informations fournies avec le produit. Elles s’appliquent, par exemple, lorsque le fabricant doit garantir un langage concis, simple ou local afin d'assurer la sécurité et les performances des dispositifs. Les exigences linguistiques au niveau de l’Union ne déterminent pas quelles langues nationales spécifiques sont requises par chaque État membre.
Exigences linguistiques au niveau national
Les autorités nationales compétentes (ANC) déterminent quelles langues nationales spécifiques sont requises pour chaque type d’informations relatives aux dispositifs ou aux médicaments sur leurs marchés respectifs. En règle générale, tous les contenus destinés aux patients doivent être disponibles dans les langues locales de chaque État membre afin de garantir la sécurité des patients. Toutefois, les autorités des États membres prennent également en compte d’autres aspects de la communication, tels que :
- Niveaux de littératie des lecteurs
- Connaissances techniques ou médicales
- Formation
Les ANC de l'UE divergent quant il s'agit de déterminer si l'anglais est considéré comme une langue communément comprise et si le contenu destiné aux utilisateurs professionnels est acceptable en anglais. Dans certains États membres, comme la France, l'Italie et d'autres États membres d'Europe de l'Est, dont la Bulgarie, la Hongrie et la Lituanie, ce contenu doit être disponible dans la langue locale :
- Marketing
- Avis de sécurité sur le terrain
- Certification
L'anglais est accepté à titre d'exemption dans certains autres pays, comme le Danemark et la Suède, États membres d'Europe du Nord.
Exigences linguistiques au niveau du produit
Les exigences au niveau du produit incluent des cas d'usage spécifiques pour certains dispositifs ou médicaments, par exemple, un dispositif de diagnostic in vitro destiné aux auto-tests ou à des tests près du patient, ou une application mobile servant à recueillir les données des patients.
Les fabricants doivent tenir compte du contexte spécifique de l’utilisation d’un dispositif ou d’un médicament pour déterminer les besoins linguistiques, dans les cas où les publications au niveau de l'Union ou national n’en tiennent pas suffisamment compte. En cas de doute, nos experts en solutions réglementaires mondiales recommandent de consulter l’organisme notifié ou les autorités nationales compétentes avant de mettre un dispositif ou un médicament sur le marché ou dans le cadre d’études cliniques.
La langue favorise l'accès, la sécurité et la transparence
Les fabricants et les promoteurs d’essais cliniques doivent garantir la conformité réglementaire aux exigences linguistiques en sciences de la vie pour entrer sur le marché de l’UE. Toutefois, les considérations linguistiques sont bien plus qu’un exercice consistant à cocher des cases. La mise à disposition des informations dans les langues locales de l’UE est essentielle pour rendre les informations accessibles, lisibles et transparentes pour tous les utilisateurs de produits ou volontaires d’essai. De plus, des traductions de haute qualité et la prise en compte des nuances culturelles aident les fabricants à étendre leur présence sur le marché et à garantir la sécurité lors de l'utilisation de leurs produits.
Contactez-nous
Vous êtes confronté à des défis liés aux exigences réglementaires linguistiques dans l'UE multilingue ? Lionbridge vous propose des solutions de conformité réglementaires dans l'UE. Nous bénéficions de plusieurs dizaines d'années d'expérience dans les langues et les réglementations de l'UE pour les dispositifs médicaux et les médicaments. Nos solutions réglementaires prennent en charge toutes les étapes du produit grâce à nos services linguistiques et de traduction dans le domaine des sciences de la vie.
Remplissez notre formulaire de contact pour démarrer une conversation avec nous.
Nous identifierons vos besoins et vous expliquerons en quoi nos fonctionnalités innovantes peuvent vous aider à éliminer les frontières et à étendre votre portée internationale. Prêt à explorer les possibilités ? Nous avons hâte de vous aider.